山野 晃史
Teamケモテクノロジーを利用したユビキチン選択的オートファジーの制御
研究分担者 山野 晃史東京医科歯科大学 難治疾患研究所 機能分子病態学分野 准教授 |
研究概要
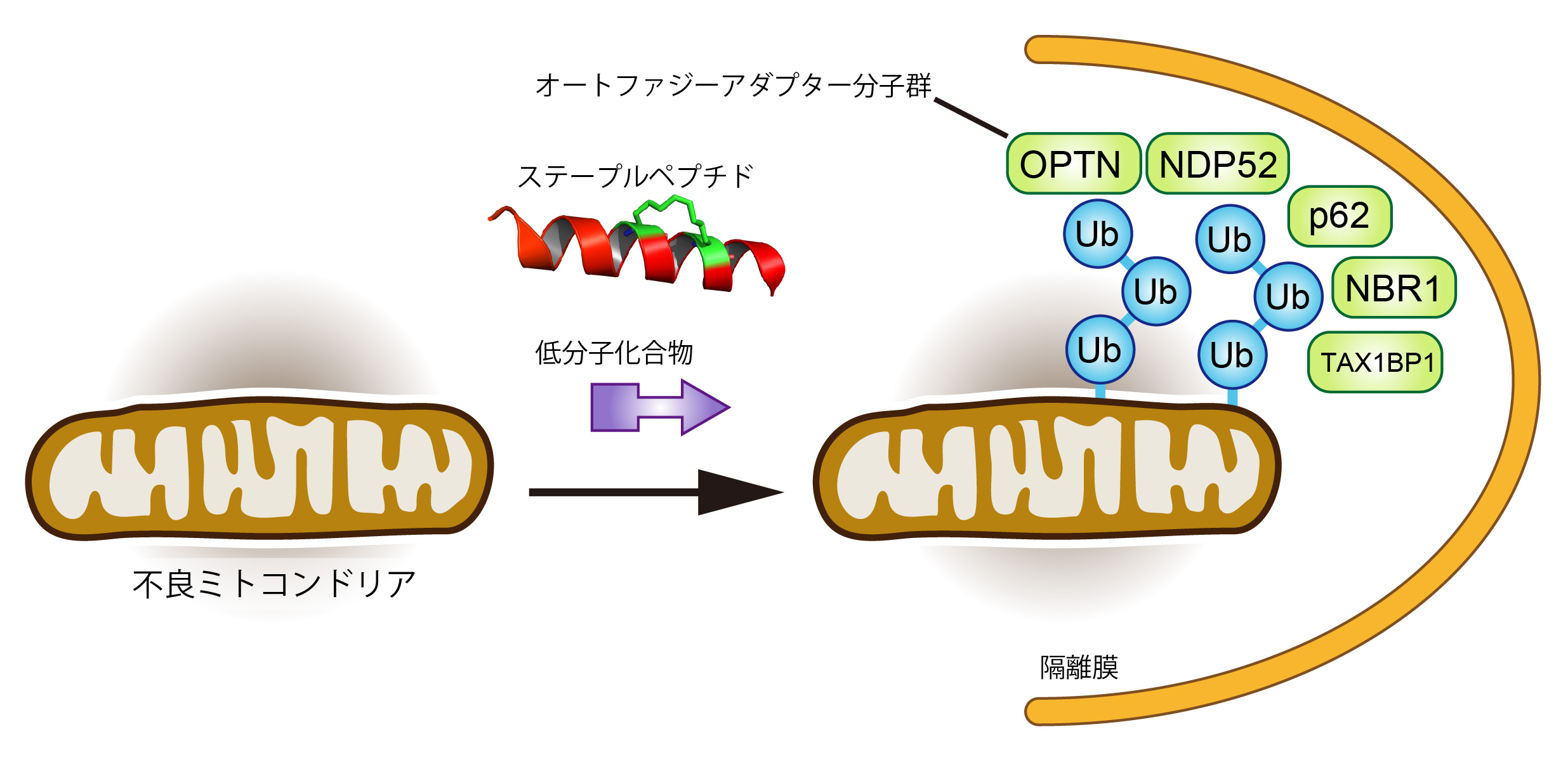
ユビキチン修飾はタンパク質分解のみならず、オートファジーを介したオルガネラ分解にも重要で、それらはユビキチン選択的オートファジーとして知られています。つまり、ユビキチン選択的オートファジーは、タンパク質凝集体や不良となった細胞内オルガネラを隔離膜で取り囲み、リソソームと融合させることにより、その内容物を選択的かつ大規模に分解することができます。そして、分解するオルガネラの選択性にユビキチン修飾とそのデコーダー分子群が重要な役割を果たしています。例えば、不良ミトコンドリアの選択的分解には、PINK1(ユビキチンをリン酸化するキナーゼ)やParkin(E3リガーゼ)が不良ミトコンドリアに対するユビキチン鎖修飾に、オートファジーアダプターと称される分子群がデコーダー(ユビキチン化オルガネラとオートファジーマシナリーを橋渡しする)に、重要であります。
本研究ではユビキチン選択的オートファジーに焦点をあて、特定のタンパク質間相互作用をタイムリーに消失させることが可能な化合物や膜透過性ペプチドを利用し、遺伝子改変や発現制御実験では解決できなかった、オルガネラ分解制御の新たな理解を目指します。また、ケモテクノロジーを利用して特定のオルガネラの選択的分解を誘導できる手法の確立を目指します。
1. オートファジー専用デコーダー分子の基質選別機構の解明
ユビキチン修飾された不良ミトコンドリアをオートファジーマシナリーへ運ぶデコーダー分子群のユビキチン鎖特異性を、化学合成したユビキチンコードや構造解析を通じて明らかにする。
2. キメラ化合物やステープルペプチドによるオルガネラ選択的分解の誘導系の開発
不良ミトコンドリアの選択的分解誘導に焦点をあて、不良ミトコンドリア上のユビキチン修飾を誘導する、あるいは不良ミトコンドリアとオートファジーマシナリーを連結させるケモテクノロジーを開発し、検証する。
研究概要を示す模式図
本領域での研究成果
- Okatsu K, Sato Y, Yamano K, Matsuda N, Negishi L, Takahashi A, Yamagata A, Goto-Ito S, Mishima M, Ito Y, Oka T, Tanaka K, *Fukai S.
Structural insights into ubiquitin phosphorylation by PINK1.
Sci. Rep. 8, 10382 (2018)
PMID: 29991771 - Koyano F, Yamano K, Kosako H, Tanaka K, *Matsuda N.
Parkin recruitment to impaired mitochondria for nonselective ubiquitylation is facilitated by MITOL.
J. Biol. Chem. 294, 10300-10314 (2019)
PMID: 31110043 - Koyano F, Yamano K, Kosako H, Kimura Y, Kimura M, Fujiki Y, Tanaka K, *Matsuda N.
Parkin-mediated ubiquitylation redistributes MITOL/March5 from mitochondria to peroxisomes.
EMBO Rep. 20, e47728 (2019)
PMID: 31602805
プレスリリース - *Yamano K, Kikuchi R, Kojima W, Hayashida R, Koyano F, Kawawaki J, Shoda T, Demizu Y, Naito M, Tanaka K, *Matsuda N.
Critical role of mitochondrial ubiquitination and the OPTN–ATG9A axis in mitophagy.
J. Cell Biol. 219, e201912144 (2020)
PMID: 32556086 - Kojima W, *Yamano K, Kosako H, Imai K, Kikuchi R, Tanaka K, Matsuda N.
Mammalian BCAS3 and C16orf70 associate with the phagophore assembly site in response to selective and non-selective autophagy.
Autophagy 17, 2011-2036 (2021)
PMID: 33499712
プレスリリース - Hayashida R, Kikuchi R, Imai K, Kojima W, Yamada T, Iijima M, Sesaki H, Tanaka K, *Matsuda N, *Yamano K.
Elucidation of ubiquitin-conjugating enzymes that interact with RBR-type ubiquitin ligases using a liquid-liquid phase separation-based method.
J Biol Chem. 299, 102822 (2023)
PMID: 36563856
関連する代表的な論文
- YHasson SA, Kane LA, Yamano K, Huang CH, Sliter DA, Buehler E, Wang C, Heman-Ackah SM, Hessa T, Guha R, Martin SE, *Youle RJ.
High-content genome-wide RNAi screens identify regulators of parkin upstream of mitophagy.
Nature 504, 291-295 (2013)
PMID: 24270810 - Kane LA, Lazarou M, Fogel AI, Yan L, Yamano K, Sarraf SA, Banerjee S, *Youle RJ.
PINK1 phosphorylates ubiquitin to activate Parkin E3 ubiquitin ligase activity.
J. Cell Biol. 205, 143-153 (2014)
PMID: 24751536 - Yamano K, Queliconi BB, Koyano F, Saeki Y, Hirokawa T, Tanaka K, Matsuda N.
Site-specific interaction mapping of phosphorylated ubiquitin to uncover Parkin activation.
J. Biol. Chem. 290, 25199-25211 (2015)
PMID: 26260794 - Yamano K, Matsuda N, Tanaka K.
The Ubiquitin signal and autophagy: an orchestrated dance leading to mitochondrial degradation.
EMBO Rep. 17, 300-316 (2016)
PMID: 26882551 - Yamano K, Wang C, Sarraf SA, Münch C, Kikuchi R, Noda NN, Hizukuri Y, Kanemaki MT, Harper W, Tanaka K, Matsuda N, Youle RJ.
Endosomal Rab cycles regulate Parkin-mediated mitophagy.
eLife. 7, e31326 (2018)
PMID: 29360040





