村田 茂穂
Teamケモテクノロジーを利用したタンパク質分解制御
研究代表者 村田 茂穂東京大学大学院薬学系研究科蛋白質代謝学教室 教授 |
研究概要
プロテアソームは真核細胞内の主たる分解系であり、生命活動を支えるタンパク質の動的な新陳代謝の中心を担っています。プロテアソームによるタンパク質分解は、高い基質選択性を持ったタンパク質分解であり、様々な生命活動の制御に必須の働きを担っています。また、その分解するターゲットの選択にユビキチン修飾とその受容体分子が重要な役割を果たしています。これまで、遺伝子改変や発現制御などの手法によりプロテアソームを介するタンパク質分解の分子機構と生理機能の解明が進められてきましたが、制御に関与する分子の多くが細胞の生存に必須であり、分解系以外での機能も有しているなどのため、多くの問題が未解明のまま残されています。
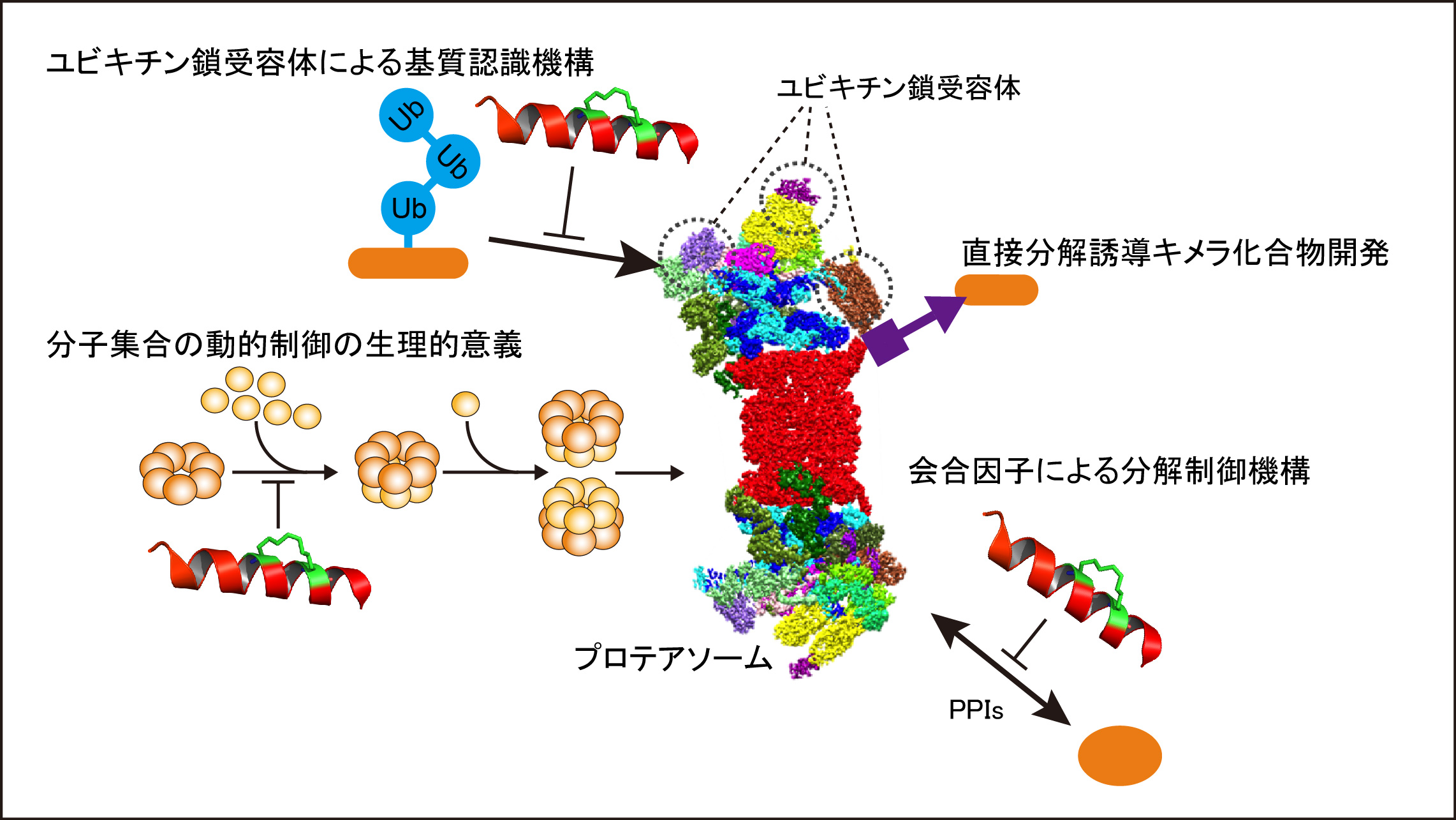
本研究ではユビキチンの主たる役割の一つであるプロテアソームを介したタンパク質分解に焦点を当て、特定のタンパク質間相互作用をタイムリーに喪失させることが可能な化合物や膜透過性ペプチドを利用し、遺伝子改変や発現制御実験では解決できなかった、基質選択性や分解系制御機構の新たな理解の解明を目指します。さらにその成果を活かして、プロテアソームと分解標的タンパク質を直接連結させるキメラ化合物を作出し、ユビキチン化を介さず直接的かつ選択的にタンパク質を分解誘導する方法論の確立を目指します。
1. プロテアソームユビキチン受容体の基質選別機構の解明
プロテアソーム上の3種類のユビキチン受容体サブユニット(RPN1, RPN10, RPN13)についてユビキチン鎖との相互作用を阻害するペプチド・化合物を取得し、各サブユニットの基質選択性とその生理作用を明らかにします。
2. プロテアソームのα -ヘリックスを標的とした相互作用分子機能解析
50種類以上にも及ぶプロテアソーム結合分子の相互作用阻害ペプチド・化合物を開発し、分解作用に対する役割を解明します。
3. 栄養環境に応答したプロテアソーム分子集合の動的制御の生理的意義の解明
栄養飢餓時にプロテアソームの形成が分単位で数倍に亢進することが知られています。そこで、隣接サブユニット間あるいはプロテアソーム形成シャペロンの相互作用を阻害するペプチドまたは化合物を開発し、プロテアソームの分子集合を阻害することにより、この動的制御の意義を解明します。
研究概要を示す模式図
本領域での研究成果
- Wu W, Sahara K, Hirayama S, Zhao X, Watanabe A, Hamazaki J, Yashiroda H, *Murata S.
PAC1‐PAC2 proteasome assembly chaperone retains the core α4–α7 assembly intermediates in the cytoplasm.
Genes to Cells 23, 839–848 (2018)
PMID: 30133132 - Tomaru U, Konno S, Miyajima S, Kimoto R, Onodera M, Kiuchi S, Murata S, Ishizu A, Kasahara M.
Restricted Expression of the Thymoproteasome Is Required for Thymic Selection and Peripheral Homeostasis of CD8+ T Cells.
Cell Rep. 26, 639-651.e2 (2019)
PMID: 30650357 - Ohigashi I, Tanaka Y, Kondo K, Fujimori S, Kondo H, Palin AC, Hoffmann V, Kozai M, Matsushita Y, Uda S, Motosugi R, Hamazaki J, Kubota H, Murata S, Tanaka K, Katagiri T, Kosako H, Takahama Y.
Trans-omics Impact of Thymoproteasome in Cortical Thymic Epithelial Cells.
Cell Rep. 29, 2901-2916.e6 (2019)
PMID: 31775054 - Otsubo R, Mimuro H, Ashida H, Hamazaki J, Murata S, Sasakawa C.
Shigella effector IpaH4.5 targets 19S regulatory particle subunit RPN13 in the 26S proteasome to dampen cytotoxic T lymphocyte activation.
Cell Microbiol. 21, e12974 (2019)
PMID: 30414351 - Bai M, Zhao X, Sahara K, Ohte Y, Hirano Y, Kaneko T, Yashiroda H, Murata S.
In-depth Analysis of the Lid Subunits Assembly Mechanism in Mammals.
Biomolecules 9, 213 (2019)
PMID: 31159305 - Arata Y, Watanabe A, Motosugi R, Iemura S, Natsume T, Mukai K, Taguchi T, Hirayama S, Hamazaki J, Murata S.
FAM48A mediates compensatory autophagy induced by proteasome impairment.
Genes to Cells 24, 559–568 (2019)
PMID: 31210371 - Arata Y, Watanabe A, Motosugi R, Murakami R, Goto T, Hori S, Hirayama S, Hamazaki J, Murata S.
Defective induction of the proteasome associated with T‐cell receptor signaling underlies T‐cell senescence.
Genes to Cells 24, 801–813 (2019)
PMID: 31621149 - Yasuda S, Tsuchiya H, Kaiho A, Guo Q, Ikeuchi K, Endo A, Arai N, Ohtake F, Murata S, Inada T, Baumeister W, Fernández-Busnadiego R, Tanaka K, *Saeki Y.
Stress- and ubiquitylation-dependent phase separation of the proteasome.
Nature 578, 296–300 (2020)
PMID: 32025036
プレスリリース
http://www.igakuken.or.jp/topics/2020/0205.html (都医学研)
https://www.amed.go.jp/news/release_20200206-02.html(AMED)
Highlighted in Cell Res
EurekAlert!
Faculty Opinions - Waku T, Nakamura N, Koji M, Watanabe H, Katoh H, Tatsumi C, Tamura N, Hatanaka A, Hirose S, Katayama H, Tani M, Kubo Y, Hamazaki J, Hamakubo T, Watanabe A, Murata S, Kobayashi A.
NRF3-POMP-20S Proteasome Assembly Axis Promotes Cancer Development via Ubiquitin-Independent Proteolysis of p53 and Retinoblastoma Protein.
Mol. Cell. Biol. 40, e597-19 (2020)
PMID: 32123008 - Hashimoto E, Okuno S, Hirayama S, Arata Y, Goto T, Kosako H, Hamazaki J, *Murata S.
Enhanced O-GlcNAcylation mediates cytoprotection under proteasome impairment by promoting proteasome turnover in cancer cells.
iScience 23, 101299 (2020)
PMID: 32634741 - Takehara Y, Yashiroda H, Matsuo Y, Zhao X, Kamigaki A, Matsuzaki T, Kosako H, Inada T, *Murata S.
The ubiquitination-deubiquitination cycle on the ribosomal protein eS7A is crucial for efficient translation.
iScience 24, 102145 (2021)
PMID: 33665564 - *Kanazawa N, Hemmi H, Kinjo N, Ohnishi H, Hamazaki J, Mishima H, Kinoshita A, Mizushima T, Hamada S, Hamada K, Kawamoto N, Kadowaki S, Honda Y, Izawa K, Nishikomori R, Tsumura M, Yamashita Y, Tamura S, Orimo T, Ozasa T, Kato T, Sasaki I, Fukuda-Ohta Y, Wakaki-Nishiyama N, Inaba Y, Kunimoto K, Okada S, Taketani T, Nakanishi K, Murata S, Yoshiura K, *Kaisho T.
Heterozygous missense variant of the proteasome subunit β-type 9 causes neonatal-onset autoinflammation and immunodeficiency.
Nature Comm. 12, 6819 (2021)
PMID: 34819510 - Watanabe A, Hama K, Watanabe K, Fujiwara Y, Yokoyama K, Murata S, *Takita R.
Controlled tetradeuteration of straight-chain fatty acids: synthesis, application, and insight into the metabolism of oxidized linoleic acid.
Angew Chem Int Ed Engl. e202202779 (2022)
PMID: 35411582 - *Tanahashi N, Komiyama M, Tanaka M, Yokobori Y, Murata S, Tanaka K.
The effect of nutrient deprivation on proteasome activity in 4-week-old mice and 24-week-old mice.
J Nutr Biochem 105, 108993 (2022)
PMID: 35331898
代表的な論文
- Hamazaki J, Hirayama S, *Murata S.
Redundant roles of Rpn10 and Rpn13 in recognition of ubiquitinated proteins and cellular homeostasis.
PLoS Genet. 11, e1005401 (2015)
PMID: 26222436 - Koizumi S, Irie T, Hirayama S, Sakurai Y, Yashiroda H, Naguro I, Ichijo H, Hamazaki J, *Murata S.
The aspartyl protease DDI2 activates Nrf1 to compensate for proteasome dysfunction.
elife. 5, e18357 (2016)
PMID: 27528193 - Uechi H, Kuranaga E, Iriki T, Takano K, Hirayama S, Miura M, Hamazaki J, *Murata S.
Ubiquitin-Binding Protein CG5445 Suppresses Aggregation and Cytotoxicity of Amyotrophic Lateral Sclerosis-linked TDP-43 in Drosophila.
Mol. Cell. Biol. 38, e00195-17 (2018)
PMID: 29109084 - *Hirayama S, Sugihara M, Morito D, Iemura S, Natsume T, Murata S, *Nagata K.
Nuclear export of ubiquitinated proteins via the UBIN-POST system.
Proc. Natl. Acad. Sci. U.S.A. 115, E4199-E4208 (2018)
PMID: 29666234 - Murata S, Takahama Y, Kasahara M, Tanaka K.
The immunoproteasome and thymoproteasome: functions, evolution and human disease.
Nat. Immunol. 19,923-931 (2018)
PMID: 30104634





