研究チーム
Team研究チーム
研究項目A01 計画研究:ケモテクノロジーによるユビキチンコードの解読と制御
ケモテクノロジーを利用したユビキチン鎖の機能解析と制御
研究代表者 岩井 一宏京都大学・大学院医学研究科・細胞機能制御学 教授 |
|
研究分担者 二木 史明京都大学化学研究所生体機能設計化学研究領域 教授 |
本計画研究の概要
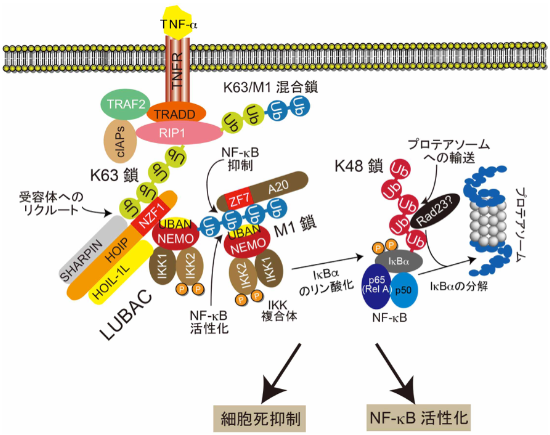
ユビキチン修飾は、修飾酵素群によってタンパク質に結合し、特異的なデコーダー分子に認識されることで機能を発現します。そして、脱ユビキチン化酵素で切断されることでその機能が終焉します。生体内には多様なユビキチン修飾が存在し、認識するデコーダー分子の違いにより同一のユビキチン修飾が生命現象をONにもOFFにも制御します。したがって、ユビキチン鎖の詳細な機能解析にはユビキチン鎖と個々のデコーダー分子との結合の選択的な阻害が不可欠ですが、既存の手法では解析は不可能であり新たな技術開発が必要です。研究代表者は自らが発見した直鎖状ユビキチン鎖(M1鎖)の研究中に、構造情報に基づいて作製した短鎖架橋ペプチド(ステープルペプチド)がタンパク質間相互作用を選択的にかつ効率的に阻害できることを見出しました。そこで本研究では、ペプチド工学に精通した研究分担者と共同してステープルペプチドを利用したユビキチン修飾と認識タンパク質の相互作用阻害手法を確立し、ユビキチン研究に有力な新解析ツールを導入します。そして、複数のユビキチン修飾が有機的に連携するTNF-αシグナル系(図参照)などをモデル系として、ケモテクノロジーを用いて以下の4点から研究を推進します。
1. ケモテクノロジーによるユビキチン鎖認識の選択的阻害
複数のユビキチン修飾が有機的に連携して機能するTNF-αシグナル系などをモデルとして解析します。
2. ユビキチン修飾の新機能のケモテクノロジー解析
ステープルペプチドを用いてM1鎖の新機能の解明に加え、TNF-αシグナル系で形成されるK63/M1混合鎖の機能解明を進めます。
3. ケモテクノロジーを用いたLUBACリガーゼの制御とその応用展開
LUBAC 複合体形成を阻害する低分子化合物の開発:すでに樹立しているTR-FRETを用いたスクリーニング系を用いて、低分子化合物阻害剤を開発します。LUBACの機能亢進が免疫チェックポイント、シスプラチン耐性に関与することが報告されており、抗がん剤のリード化合物となる可能性も大きいので精力的に解析します。
4. ステープルペプチドの作出支援
本領域の中で、ステープルペプチドの作出を担当するとともに、研究分担者の創製したタンパク質を含む様々な分子を細胞質の効率的に導入可能な膜透過ペプチドを用いてケミカルツールの細胞内への効率的な導入を支援します。
研究概要を示す模式図
本領域での研究成果
- *MacDuff DA, Baldridge MT, Qaqish AM, Nice TJ, Darbandi AD, Hartley VL, Peterson ST, Miner JJ, Iwai K, *Virgin HW.
HOIL1 is essential for the induction of type I and III interferons by MDA5 and regulates persistent murine norovirus infection.
J. Virol. 92, e01368-18 (2018)
PMID: 30209176 - Wu M, Chang Y, Hu H, Mu R, Zhang Y, Qin X, Duan X, Li W, Tu H, Zhang W, Wang G, Han Q, Li A, Zhou T, Iwai K, Zhang X *Li H.
LUBAC controls chromosome alignment by targeting CENP-E to attached kinetochores.
Nat. Commun. 10, 273 (2019)
PMID: 30655516 - Ishii N, Walinda E, Iwakawa N, Morimoto D, Iwai K, Sugase K, *Shirakawa M.
NMR resonance assignments of the NZF domain of mouse HOIL-1L free and bound to linear di-ubiquitin.
Biomol. NMR Assign. 13, 149-153 (2019)
PMID: 30569274 - Sasaki K, Himeno A, Nakagawa T, Sasaki Y, Kiyonari H, *Iwai K.
Modulation of autoimmune pathogenesis by T cell-triggered inflammatory cell death.
Nat. Commun. 10, 3878 (2019)
PMID: 31462647
プレスリリース - Kawaguchi Y, Ise S, Azuma Y, Takeuchi T, Kawano K, Le TK, Ohkanda J, *Futaki S. Dipicolylamine/metal complexes that promote direct cell-membrane penetration of octaarginine.
Bioconjug. Chem. 30, 454-460 (2019)
PMID: 30428256 - Brazee PL, Morales-Nebreda L, Magnani ND, Garcia JG, Misharin AV, Ridge KM, Budinger GRS, Iwai K, Dada LA, *Sznajder JI.
Linear ubiquitin assembly complex regulates lung epithelial-driven responses during influenza infection.
J. Clin. Invest. 130, 1301-1314 (2020)
PMID: 31714898 - Arafiles JVV, Hirose H, Akishiba M, Tsuji S, Imanishi M, *Futaki S.
Stimulating macropinocytosis for intracellular nucleic acid and protein delivery: a combined strategy with membrane-lytic peptides to facilitate endosomal escape.
Bioconjug. Chem. 31, 547-553 (2020)
PMID: 32017537 - Tamemoto N, Akishiba M, Sakamoto K, Kawano K, Noguchi H, *Futaki S.
Rational Design Principles of Attenuated Cationic Lytic Peptides for Intracellular Delivery of Biomacromolecules.
Mol. Pharm. 17, 2175-2185 (2020)
PMID: 32352304 - Sakamoto K, Akishiba M, Iwata T, Murata K, Mizuno S, Kawano K, Imanishi M, Sugiyama F, *Futaki S.
Optimizing Charge Switching in Membrane Lytic Peptides for Endosomal Release of Biomacromolecules.
Angew. Chem. Int. Ed. Engl. 59, 19990-19998 (2020)
PMID: 32557993 - Fuseya Y, Fujita H, Kim M, Ohtake F, Nishide A, Sasaki K, Saeki Y, Tanaka K, Takahashi R, Iwai K.
The HOIL-1L ligase modulates immune signaling and cell death via mono-ubiquitination of LUBAC.
Nat. Cell Biol. 22, 663-673 (2020)
PMID: 32393887
プレスリリース - Jo T, *Nishikori M, Kogure Y, Arima H, Sasaki K, Sasaki Y, Nakagawa T, Iwai F, Momose S, Shiraishi A, Kiyonari H, Kagaya N, Onuki T, Shin-ya K, Yoshida M, Kataoka K, Ogawa S, *Iwai K, Takaori-Kondo A.
LUBAC accelerates B-cell lymphomagenesis by conferring B cells resistance to genotoxic stress.
Blood. 136, 684–697 (2020)
PMID: 32325488
プレスリリース - Arafiles JVV, Hirose H, Hirai Y, Kuriyama M, Sakyiamah MM, Nomura W, Sonomura K, Imanishi M, Otaka A, Tamamura H, *Futaki S.
Discovery of a macropinocytosis-inducing peptide potentiated by medium-mediated intramolecular disulfide formation.
Angew. Chem. Int. Ed. Engl. 60,11928-11936 (2021)
PMID: 33629482 - Morimoto D, Walinda E, Takashima S, Nishizawa M, Iwai K, Shirakawa M, *Sugase K.
Structural dynamic heterogeneity opolyubiquitin subunits affects phosphorylation susceptibility.
Biochemistry 60, 573-583 (2021)
PMID: 33616406 - Yoshida Y, Asahina M, Murakami A, Kawawaki J, Yoshida M, Fujinawa R, Iwai K, Tozawa R, Matsuda N, Tanaka K and Suzuki T.
Loss of peptide:N-glycanase causes proteasome dysfunction mediated by a sugar-recognizing ubiquitin ligase.
Proc. Natl. Acad. Sci. USA 118, e2102902118 (2021)
PMID: 34215698 - Walinda E, Morimoto D, Sorada T, Iwai K, Sugase K.
Expression, solubility monitoring, and purification of the co-folded LUBAC LTM domain by structure-guided tandem folding in autoinducing cultures.
Protein Expr. Purif. 187,105953 (2021)
PMID: 34390872 - Iwata T, Hirose H, Sakamoto K, Hirai Y, Arafiles JVV, Akishiba M, Imanishi M, *Futaki S. Liquid Droplet Formation and Facile Cytosolic Translocation of IgG in the Presence of Attenuated Cationic Amphiphilic Lytic Peptides.
Angew. Chem. Int. Ed. Engl. 60, 19804-19812 (2021)
PMID: 34114295 - Nitschke S, Sullivan MA, Mitra S, Marchioni CR, Lee JPY, Smith BH, Ahonen S, Wu J, Chown EE, Wang P, Petković S, Zhao X, DiGiovanni LF, Perri AM, Israelian L, Grossman TR, Kordasiewicz H, Vilaplana F, Iwai K, Nitschke F, Minassian BA.
Glycogen synthase downregulation rescues the amylopectinosis of murine RBCK1 deficiency.
- Shinkawa Y, Imami K, Fuseya Y, Sasaki K, Ohmura K, Ishihama Y, Morinobu A, Iwai K.
ABIN1 is a signal-induced autophagy receptor that attenuates NF-kB activation by recognizing linear ubiquitin chains.
FEBS Lett. 596, 1147-1164 (2022)
PMID: 35213742 - Wood MJ, Marshall JN, Hartley VL, Liu TC, Iwai K, Stappenbeck TS and MacDuff DA. HOIL1 regulates group 2 innate lymphoid cell numbers and type 2 inflammation in the small intestine.
Mucosal Immunol. 15, 642-655 (2022)
PMID: 35534698 - Nakagawa Y, Arafiles JVV, Kawaguchi Y, Nakase I, Hirose H, Futaki S.
Stearylated Macropinocytosis-Inducing Peptides Facilitating the Cellular Uptake of Small Extracellular Vesicles.
Bioconjug. Chem. 33, 869-880 (2022)
PMID: 35506582 - Okano S, Kawaguchi Y, Kawano K, Hirose H, Imanishi M, Futaki S.
Split luciferase-based estimation of cytosolic cargo concentration delivered intracellularly via attenuated cationic amphiphilic lytic peptides.
Bioorg .Med. Chem. Lett. 72, 128875 (2022)
PMID: 35798239 - Hirose H, Hirai Y, Sasaki M, Sawa H, Futaki S.
Quantitative Analysis of Extracellular Vesicle Uptake and Fusion with Recipient Cells.
Bioconjug. Chem. 33, 1852-1859 (2022)
PMID: 36194183 - Jimbo K, Hattori A, Koide S, Ito T, Sasaki K, Iwai K, Nannya Y, Iwama A, Tojo A, and Konuma T.
Genetic deletion and pharmacologic inhibition of E3 ubiquitin ligase HOIP impairs the propagation of myeloid leukemia.
Leukemia 37, 122-133 (2023)
PMID: 36352193 - Hiragi K, Nishide A, Takagi K, Iwai K, Kim M, and Mizushima T.
Structural insight into the recognition of the linear ubiquitin assembly complex by Shigella E3 ligase IpaH1.4/2.5.
J. Biochem. (2023) Jan 4:mvac109.
PMID: 36610722
関連する代表的な論文
- Tokunaga F, Sakata S-I, Saeki Y, Satomi Y, Kirisako T, Kamei K, Nakagawa T, Kato M, Murata S, Yamaoka S, Yamamoto M, Akira S, Takao T, Tanaka K, Iwai K.
Involvement of linear polyubiquitination of NEMO in NF-kB activation.
Nat. Cell Biol. 11, 123-132 (2009)
PMID :19136968 - Tokunaga F, Nakagawa T, Nakahara M, Saeki Y, Taniguchi M, Sataka S-I, Tanaka K, Nakano H, Iwai K.
SHARPIN is a component of the NF-kB activating linear ubiquitin chain assembly complex.
Nature 471, 633-636 (2011)
PMID: 21455180 - Fujita H, Rahighi S, Akita M, Kato R, Sasaki Y, Wakatsuki S, Iwai K.
Mechanism underlying IKK activation mediated by the linear ubiquitin chain assembly complex (LUBAC).
Mol. Cell. Biol. 34, 1322-1335 (2014)
PMID: 24469399 - Iwai K, Fujita H, Sasaki Y.
Linear ubiquitin chains: NF-kB signalling, cell death, and beyond.
Nat. Rev. Mol. Cell Biol. 15, 503-508 (2014)
PMID: 25027653 - Yang Y, Schmitz R, Mitala J, Whiting A, Xiao W, Ceribelli M, Wright GW, Zhao H, Yang Y, Xu W, Rosenwald A, Ott G, Gascoyne RD, Connors JM, Rimsza LM, Campo E, Jaffe ES, Delabie J, Smeland EB, Braziel RM, Tubbs RR, Cook JR, Weisenburger DD, Chan WC, Wiestner A, Kruhlak MJ, Iwai K, Bernal F, Staudt LM.
Essential role of the linear ubiquitin chain assembly complex in lymphoma revealed by rare germline polymorphisms.
Cancer Discov. 4, 480-493 (2014)
PMID: 24491438 - Shimizu S, Fujita H, Sasaki Y, Tsuruyama T, Fukuda K, Iwai K.
Differential Involvement of the Npl4 Zinc Finger Domains of SHARPIN and HOIL-1L in Linear Ubiquitin Chain Assembly Complex-Mediated Cell Death Protection.
Mol. Cell. Biol. 36, 1569-1583 (2016)
PMID: 26976635 - Nakase I, Noguchi K, Aoki A, Takatani-Nakase T, Fujii I, Futaki S.
Arginine-rich cell-penetrating peptide-modified extracellular vesicles for active macropinocytosis induction and efficient intracellular delivery.
Sci. Rep. 7, 1991 (2017)
PMID: 28512335 - Akishiba M, Takeuchi T, Kawaguchi Y, Sakamoto K, Yu HH, Nakase I, Takatani-Nakase T, Madani F, Gräslund A, Futaki S.
Cytosolic antibody delivery by lipid-sensitive endosomolytic peptide.
Nat. Chem. 9, 751-761 (2017)
PMID: 28754944 - Futaki S, Nakase I.
Cell-surface interactions on arginine-rich cell-penetrating peptides allow for multiplex modes of internalization.
Acc. Chem. Res. 50, 2449-2456 (2017)
PMID: 28910080 - Tamiya H, Kim H, Klymenko O, Kim H, Feng Y, Zhang T, Han JY, Murao A, Snipas SJ, Jilaveanu L, Brown K, Kluger H, Zhang H, Iwai K, Ronai ZA.
SHARPIN-mediated regulation of protein arginine methyltransferase 5 controls melanoma growth.
J. Clin. Invest. 128, 517-530 (2018)
PMID: 29227283 - Sakagami K, Masuda T, Kawano K, Futaki S.
Importance of net hydrophobicity in the cellular uptake of all-hydrocarbon stapled peptides.
Mol. Pharm. 15, 1332-1340 (2018)
PMID: 29420899 - Fujita H, Tokunaga A, Shimizu S, Whiting AL, Aguilar-Alonso F, Takagi K, Walinda E, Sasaki Y, Shimokawa T, Mizushima T, Ohki I, Ariyoshi M, Tochio H, Bernal F, Shirakawa M, Iwai K.
Cooperative domain formation by homologous motifs in HOIL-1L and SHARPIN plays crucial roles in LUBAC stabilization.
Cell Rep. 23, 1192-1204 (2018)
PMID: 29694895





