水上 進
光可逆的蛋白質ラベル化技術に基づく蛋白質分解の時空間制御
 |
研究代表者 水上 進東北大学多元物質科学研究所・細胞機能分子化学研究分野 教授 |
|---|
研究概要
生命科学分野において、光で生命機能を制御する技術を用いた研究が盛んに行われています。もし、ユビキチン-プロテアソームシステム(UPS)による蛋白質分解を光制御できれば、時空間分解能を持つ蛋白質の翻訳後レベルノックダウンが達成され、生命科学全体に波及する革新技術になると期待できます。私たちは、有機化学的手法と分子生物学的手法を融合させた「生体分子機能解析技術」を開発してきました。具体的には、①生体内・細胞内分子の可視化技術、②蛋白質ラベル化技術、③生体分子の光活性化技術を報告してきました。最近では、②と③の技術を融合させた光照射によってタグ蛋白質に機能性低分子をラベルする技術の開発を行っています。これまでにケージド化合物を利用した「非可逆的光ラベル化技術」、およびフォトクスイッチ化合物を利用した「可逆的光ラベル化技術」の二種類を開発しています。
そこで、この光制御可能な蛋白質ラベル化技術を、低分子リガンドに基づいた蛋白質分解制御技術(PROTACs/SNIPERs)と融合させることで、光照射によって生細胞内に発現する標的蛋白質を高い時空間分解能で分解する技術を開発します。光を用いることで、特定のタイミングで特定の細胞やオルガネラのみで標的蛋白質を分解できると期待されます。さらに、可逆的な光ラベル化技術は、照射光波長に応じてフォトスイッチリガンドの結合割合を制御できる為、定量的な蛋白質濃度制御に繋がる可能性があります。本研究では次の2つの技術を開発する予定です。
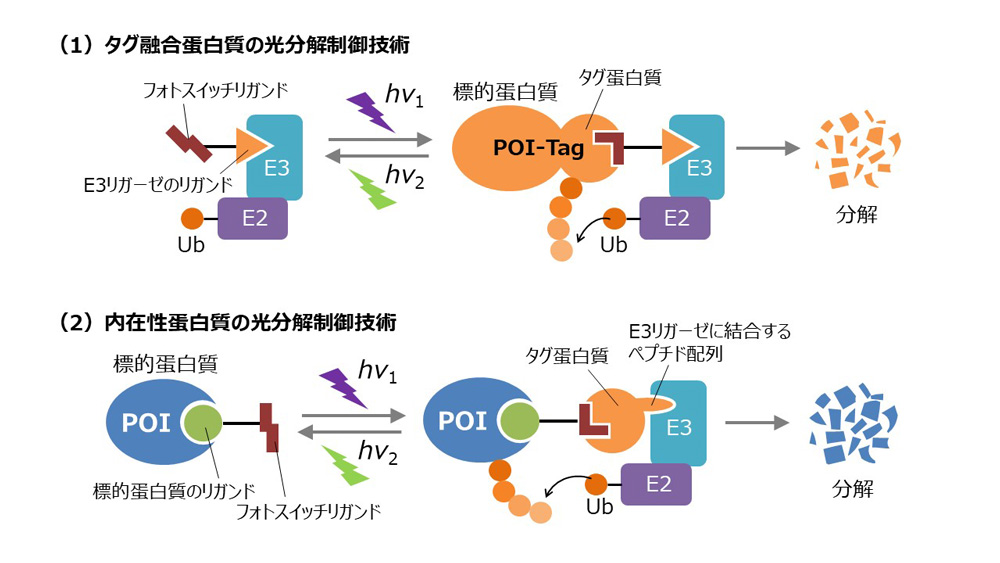
- タグ融合蛋白質の光分解制御技術(図(1))
開発した蛋白質光ラベル化技術のリガンドと、内在性E3リガーゼのリガンドを併せ持つ二官能性の光分解誘導剤を合成し、この分子存在下で光照射することで蛋白質タグ融合標的蛋白質を任意の場所・タイミングで選択的にポリユビキチン化し、分解を誘導します。 - 内在性蛋白質の定量的光分解制御技術(図(2))
光分解誘導剤として、光ラベル化リガンドと標的蛋白質のリガンドを併せ持つ分子を合成します。E3リガーゼに結合するペプチドを融合させたタグ蛋白質を細胞内に発現させ、光分解誘導剤の存在下、光照射による複合体形成を誘導し、内在性の標的蛋白質を光で分解するシステムを開発します。
研究概要を示す模式図
本領域での研究成果
- Mashita T, Kowada T, Takahashi H, Matsui T, *Mizukami S.
Light-wavelength-based Quantitative Control of Dihydrofolate Reductase Activity Using Photochromic Isostere of Inhibitor.
ChemBioChem 20, 1382–1386 (2019)
PMID: 30656808 - Imoto T, Muramatsu M, Miyasaka H, Mizukami S, *Kikuchi K.
Improvement in Photostability of Fluorescein by Lanthanide Ions based on Energy Transfer-Based Triplet State Quenching.
Chem. Lett. 48, 1181–1184 (2019) - Kowada T, Watanabe T, Amagai Y, Liu R, Yamada M,Takahashi H, Matsui T, Inaba K, *Mizukami S.
Quantitative imaging of labile Zn2+ in the Golgi apparatus using a localizable small-molecule fluorescent probe.
Cell Chem. Biol. 27, 1521–1531 (2020)
PMID: 32997976
プレスリリース - Kowada T, Arai K, Yoshimura A, Matsui T, Kikuchi K, *Mizukami S.
Optical manipulation of subcellular protein translocation using a photoactivatable covalent labeling system.
Angew. Chem. Int. Ed. AOP (2021)
PMID: 33644979 - Kowada T, Watanabe T, Liu R, *Mizukami S.
Protocol for synthesis and use of a turn-on fluorescent probe for quantifying labile Zn2+ in the Golgi Apparatus in live cells.
STAR Protoc. 2, 100395 (2021)
代表的な論文
- Mizukami S, Hosoda M, Satake T, Okada S, Hori Y, Furuta T, *Kikuchi K.
Photocontrolled Compound Release System Using Caged Antimicrobial Peptide.
J. Am. Chem. Soc. 132, 9524–9525 (2010)
PMID: 20583831 - Mizukami S, Watanabe S, Akimoto Y, *Kikuchi K.
No-Wash Protein Labeling with Designed Fluorogenic Probes and Application to Real-Time Pulse-Chase Analysis.
J. Am. Chem. Soc. 134, 1623–1629 (2012)
PMID: 22224915 - Mizukami S, Hori Y, *Kikuchi K.
Small-Molecule Based Protein-Labeling Technology in Live Cell Studies: Probe-Design Concepts and Applications.
Acc. Chem. Res. 47, 247–256 (2014)
PMID: 23927788 - Matsui Y, Funato Y, Imamura H, Miki H, *Mizukami S, *Kikuchi K.
Visualization of Long-term Mg2+ Dynamics in Apoptotic Cells with a Novel Targetable Fluorescent Probe.
Chem. Sci. 8, 8255–8264 (2017)
PMID: 29619172





