宮前 友策
脱ユビキチン化酵素の切断機構を活用した細胞内タンパク質発現制御法の開発
 |
研究代表者 宮前 友策筑波大学 生命環境系 准教授 |
|---|
研究概要
細胞内の標的タンパク質(protein-of-interest: POI)の安定性や機能を制御するための技術は、基礎生物学や医学における強力な分子ツールです。近年POIをコードする遺伝子配列のいずれかの末端部位に、分解を誘発するポリペプチド(degron: デグロン)を遺伝子工学的に付加し、デグロンを融合したタンパク質の発現のオンオフを、化合物や光の照射により制御する化学的手法が開発されています。これらの手法は、RNAiやCre/loxPシステムと異なり、翻訳後レベルで制御できるため、刺激後30分から1時間以内に発現の制御が可能な利点があります。しかし、現在までに報告されているデグロン法のほとんどが、POIに対してデグロンタグ(25~100アミノ酸残基前後)を恒久的に融合させる必要があり、タンパク質の種類によっては、本来有する分子機能を損ねる可能性が指摘されていました。
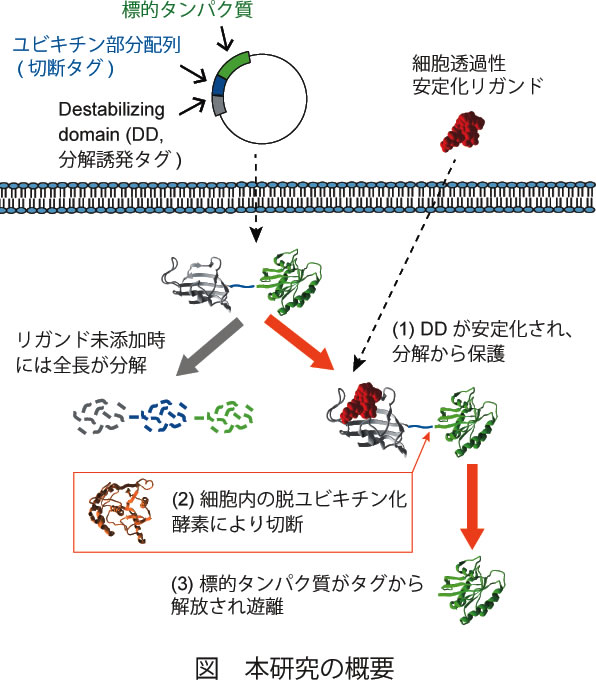
本研究では、私たちが独自に見出した、脱ユビキチン化酵素(deubiquitinase: DUB)の基質配列の改変による切断速度の調節現象と、小分子化合物に応答するデグロン分子を組み合わせた新たな方法論を構築し、次世代型のタンパク質発現制御ツールの確立を目指します。具体的には、共同研究者であるWandlessらが開発した小分子応答性デグロンであるdestabilizing domain (DD) のC末端とPOIのN末端の間に、DUBによる緩やかな切断を受けるユビキチン(Ub)の部分配列を「切断タグ」として挿入した融合タンパク質を用います。この融合タンパク質は、細胞内に発現させるとDDの不安定性により速やかに分解されます。一方、DDに結合する安定化リガンドを添加することにより、DDの構造が安定化された後、次いで細胞内のDUBによりPOIが切断タグのC末端から切断され、タグから解放されます(図参照)。これにより、POIの発現量を、細胞が本来有するありのままの姿で制御することが可能になると考えられます。本研究では、切断タグとしてのUb部分配列の最適化を行った後、制御可能なタンパク質の種類等を検証し、標的タンパク質発現制御法としての基本的性能を明らかにします。さらに、ゲノム編集技術を用いて内在性タンパク質制御への適用を目指すとともに、キメラ抗原受容体の発現制御を試行し、免疫療法への応用可能性を検証します。
研究概要を示す模式図
代表的な論文
- Ohtera A, *Miyamae Y, Yoshida K, Maejima K, Akita T, Kakizuka A, Irie K, Masuda S, Kambe T, *Nagao M. Identification of a new type of covalent PPARg agonist using a ligand-linking strategy.
- *Miyamae Y, Nishito Y, Nakai N, Nagumo Y, Usui T, Masuda S, Kambe T, *Nagao M. Tetrandrine induces lipid accumulation through blockade of autophagy in a hepatic stellate cell line.
- Utsugi Y, Kobuchi H, Kawamura Y, Atito ASA, Nagao M, Isoda H, *Miyamae Y. Importance of the proximity and orientation of ligand-linkage to the design of cinnamate-GW9662 hybrid compounds as covalent PPARg agonists.
- Kurata M, Fujiwara N, Fujita K, Yamanaka Y, Seno S, Kobayashi H, Miyamae Y, Takahashi N, Shibuya M, *Masuda S. Food-derived compounds apigenin and luteolin modulate mRNA splicing of introns with weak splice sites.
- Miyamae Y, Chen LC, Utsugi Y, Farrants H, *Wandless T J. A method for conditional regulation of protein stability in native or near-native form.
ACS Chem. Biol. 10, 2794-2804 (2015)
PMID: 26414848
Biochem. Biophys. Res. Commun. 477, 40-46 (2016)
PMID: 27270032
Molecules 24, 2019 (2019)
PMID: 31137814
iScience 22, 336-352 (2019)
PMID: 31809999
Cell Chem. Biol. 27, 1573-1581 (2020)
PMID: 33007216





