前川 大志
Bivalent DNAアプタマーによるプロテインノックダウン法の開発
 |
研究代表者 前川 大志慶應義塾大学 薬学部・薬学研究科 代謝生理化学講座 専任講師 |
|---|
研究概要
プロテインノックダウン法は、ユビキチン (Ub) -プロテアソーム経路やオートファジー経路を利用して標的タンパク質を特異的に分解する手法です。本手法は近年、細胞内タンパク質に対する分子標的創薬(臨床応用)と標的タンパク質の機能解析ツール (基礎研究)の2つの側面から大きく注目され、加速的に研究開発が進んでいます。一方で、既存のUb-プロテアソーム経路によるプロテインノックダウン法では、利用可能なリガンドが限定的である事や特異性の低さ等が課題となっており、標的タンパク質を自由自在に強制的に分解に導くプロテインノックダウン法は未開発のままです。従って、自在なプロテインノックダウン法の確立には、Ubリガーゼと標的タンパク質のリガンドのレパートリーを飛躍的に拡充していく必要があります。
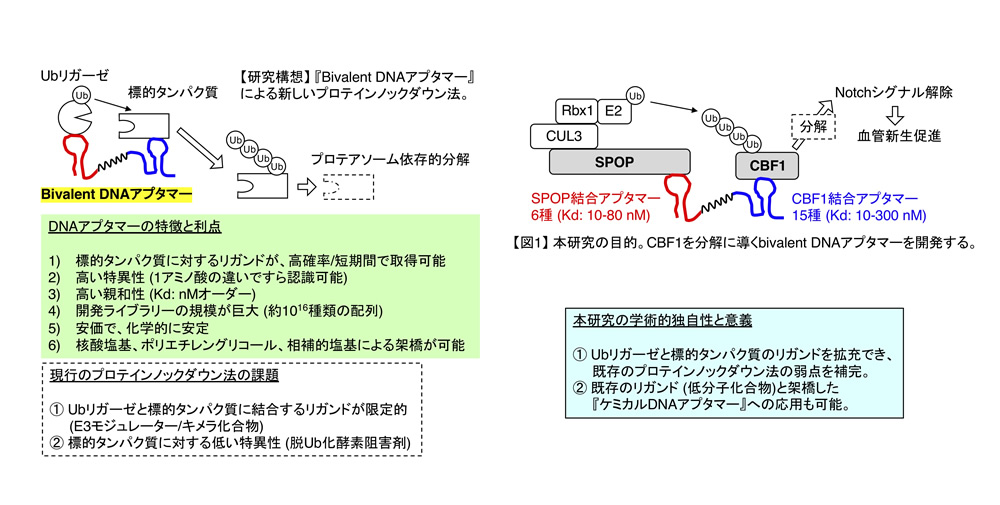
本研究において我々が利用するDNAアプタマーは、標的分子に結合する約30〜70塩基の1本鎖DNAで、SELEX (Systematic Evolution of Ligands by EXponential enrichment) 法により開発できます。SELEX法の最大の特徴は、最初の配列ライブラリーが極めて膨大(ランダム配列が30塩基の場合: 約1016)である点です。SELEX法を利用する事で、DNAアプタマーを高い親和性と特異性で結合するリガンドとして短期間に高確率で取得する事ができます。即ち、標的タンパク質やUbリガーゼに結合するDNAアプタマー同士を架橋した『bivalent DNAアプタマー』は、標的タンパク質をUbリガーゼに近接させ、Ub化とその後の分解を促進し得るので、自在に標的タンパク質を分解できるプロテインノックダウン法の基盤ツールになり得ます(研究構想図)。
本研究では、我々が開発したNotchシグナル転写因子CBF1に結合するDNAアプタマーを標的タンパク質のリガンド、CUL3型Ubリガーゼ複合体の基質認識受容体であるSPOPに結合するDNAアプタマーをUbリガーゼのリガンドとし、両者を架橋したbivalent DNAアプタマーを合成します(図1)。本研究を通して、bivalent DNAアプタマーによるCBF1のUb化とタンパク質分解の促進をin vitroと細胞レベルで実証し、bivalent DNAアプタマーを新たなプロテインノックダウンの手法として確立します。更に、将来的な臨床応用を志向して、脂質ナノ粒子等を用いた高効率且つ、無毒なbivalent DNAアプタマーの細胞内導入方法を検討し、将来的な生体内へのdrug delivery systemの構築も同時に行います。
研究概要を示す模式図
本領域での研究成果
- Nishiyama K, *Maekawa M (co-first), Nakagita T, Nakayama J, Kiyoi T, Chosei M, Murakami A, Kamei Y, Takeda H, Takada Y, *Higashiyama S.
CNKSR1 serves as a scaffold to activate an EGFR phosphatase via exclusive interaction with RhoB-GTP.
Life Sci. Alliance.4, e202101095 (2021)
PMID: 34187934 - Sanada S, *Maekawa M (co-first), Tate S, Nakaoka H, Fujisawa Y, Sayama K, *Higashiyama S.
SPOP is essential for DNA replication licensing through maintaining translation of CDT1 and CDC6 in HaCaT cells.
Biochem. Biophys. Res. Commun. 651, 30-38 (2023)
PMID: 36791496
代表的な論文
- Maekawa M, Terasaka S, Mochizuki Y, Kawai K, Ikeda Y, Araki N, Skolnik EY, *Taguchi T, *Arai H.
Sequential breakdown of 3-phospholylated phosphoinositides is essential for the completion of macropinocytosis.
Proc. Natl. Acad. Sci. USA. 111, E978-E987 (2014)
PMID: 24591580 - Maekawa M, *Fairn GD.
Complementary probes reveal that phosphatidylserine is required for proper transbilayer distribution of cholesterol.
J. Cell Sci. 128, 1422-1433 (2015)
PMID: 25663704 - Murakami A, *Maekawa M (co-first), Kawai K, Nakayama J, Araki N, Semba K, Taguchi T, Kamei Y, Takada Y, *Higashiyama S.
Cullin-3/KCTD10 E3 complex is essential for Rac1 activation through RhoB degradation in human epidermal growth factor receptor 2-positive breast cancer cells.
Cancer Sci. 110, 650-661 (2019)
PMID: 30515933 - Watanabe R, *Maekawa M (co-first), Hieda M, Taguchi T, Miura N, Kikugawa T, Saika T, *Higashiyama S.
SPOP is essential for DNA-protein crosslink repair in prostate cancer cells: SPOP-dependent removal of topoisomerase 2A from the topoisomerase 2A-DNA cleavage complex.
Mol. Biol. Cell.31, 478-490 (2020)
PMID: 31967940 - Tezuka-Kagajo M, *Maekawa, M (co-first), *Ogawa A (co-first), Hatta Y, Ishii E, Eguchi M, *Higashiyama S.
Development of human CBF1-targeting single-stranded DNA aptamers with anti-angiogenic activity in vitro.
Nucleic Acid Ther. 30, 365-378 (2020)
PMID: 32881630





