川口 充康
プロテアソーム分解過程可視化蛍光プローブの開発と新規プロテアソーム阻害剤の探索
 |
研究代表者 川口 充康名古屋市立大学大学院 薬学研究科 薬化学研究室 講師 |
|---|
研究概要
プロテアソーム阻害剤ボルテゾミブが抗がんとして開発・臨床応用されて以来、プロテアソーム阻害剤の薬効、潜在性に注目が集まっています。しかし、ボルテゾミブに耐性を示す症例も散見されるため新たな作用機序を持つプロテアソーム阻害剤の開発が切望されています。ただ、従来のプロテアソーム阻害剤はプロテアーゼ活性を示す20Sコア粒子中のb1, 2, 5サブユニットを標的とするものが多く、新たな標的タンパク質の創出が不可欠である一方で、それを制御する化合物を効率的に探索する術がありませんでした。
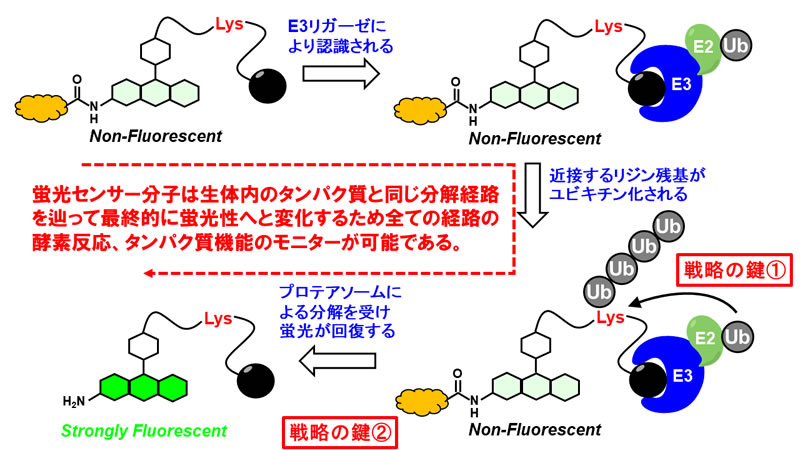
そこで、本研究では『プローブ分子自身をユビキチン-プロテアソーム経路の基質と見做し、i) ユビキチン化過程、ii) 26Sプロテアソームへの取り込み過程、iii) プロテアソーム分解過程の全てが進行した場合に限り蛍光性を示す』といった全く新しい検出戦略を考案し、プロテアソーム分解過程の一部始終を一気通貫かつ生細胞中にて観察できる「蛍光性小分子プローブ」の開発を目指します。また、開発した蛍光プローブをin cellulo表現型スクリーニングに適用し、これまでにない標的・作用機序を持つプロテアソーム阻害剤を探索・開発し、抗がん剤リードとしての有効性を実証します。
また、本研究のプローブ開発を行う中で鍵となる問いとして「ユビキチン化を受ける基質はタンパク質である必要があるか?」という疑問があり、それに対する答えを得ることも目指します。即ち、従来のユビキチン化基質はタンパク質が一般的ですが、リジン残基を持つペプチド鎖、或いはリジン残基のみ、さらには脂肪族のアミノ基でさえ基質として十分な可能性があります。本研究でその疑問を明らかにすることで、ケミカルバイオロジー研究としてPROTACsを用いた分解操作技術の応用の幅が広げられるだけでなく、生体内でユビキチン-プロテアソーム系により分解を受ける分子に関しても視野を広げ、見直す必要性・機会を提示できる可能性があります。さらに、これまでにない標的分子・制御小分子を明らかにできれば、プロテアソーム創薬の幅を広げ将来的な創薬研究の成功確率を高めることに繋がります。
研究概要を示す模式図
代表的な論文
- Kawaguchi M, Ieda N, *Nakagawa H.
Development of peptide-based sirtuin defatty-acylase inhibitors identified by fluorescence probe, SFP3 that can efficiently measure defatty-acylase activity of sirtuin.
J. Med. Chem. 62, 5434-5452 (2019)
PMID: 31117516 - *Kawaguchi M, Han X, Hisada T, Nishikawa S, Kano K, Ieda N, Aoki J, Toyama T, *Nakagawa H.
Development of an ENPP1 fluorescence probe for inhibitor screening, cellular imaging and prognostic assessment of malignant breast cancer.
J. Med. Chem.62, 9254-9269 (2019)
PMID: 31536342 - Sakamoto S, *Komatsu T, *Watanabe R, Zhang Y, Inoue T, Kawaguchi M, Nakagawa H, Honda K, *Noji H, *Urano Y.
Single enzyme activity-based protein profiling – multiplex single-molecule analysis for counting enzymes for functional identification.
Sci. Adv. 6, eaay0888 (2020)
PMID: 32195342 - *Kawaguchi M, Okabe T, Okudaira S, Hama K, Kano K, Nishimasu H, Nakagawa H, Ishitani R, Kojima H, Nureki O, Aoki J, *Nagano T.
Identification of potent in vivo autotaxin inhibitors that bind to both hydrophobic pocket and channel in the catalytic domain.
J. Med. Chem. 63, 3188-3204 (2020)
PMID: 32134652 - Nakajima Y, *Kawaguchi M, Ieda N, *Nakagawa H.
A Set of Highly Sensitive Sirtuin Fluorescence Probes for Screening Small-Molecular Sirtuin Defatty-Acylase Inhibitors.
ACS Med. Chem. Lett. 12, 617-624 (2021)
PMID: 33859801





