川原 裕之
ケモテクノロジーを活用したプレエンプティヴ経路特異的Ubデコーダーの作動機構解明
 |
研究代表者 川原 裕之東京都立大学 理学部 生命科学科 細胞生化学研究室 教授 |
|---|
研究概要
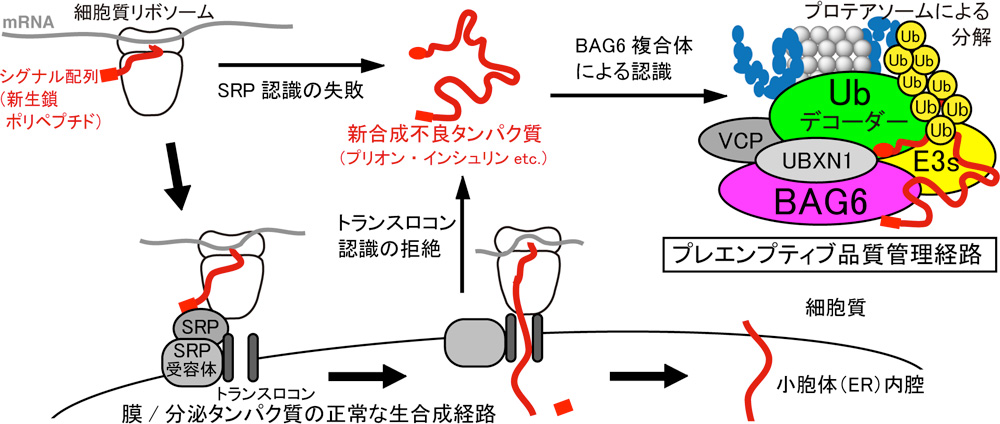
タンパク質の新合成には厳密な品質管理が必要です。最近、このようなタンパク質品質管理の場に、新しいユビキチンバイオロジーの存在が浮かび上がってきました。特に、ストレス条件下ではシグナル配列の認識不良、およびトランスロコンからの拒絶などが誘起され、シグナル配列をN末端に持ったまま(正常な小胞体内プロセシングを受けないまま)の不良膜タンパク質が細胞質に蓄積します。凝集性の高い不良膜タンパク質の蓄積を防ぐため、新しい細胞質性ユビキチン依存的分解経路の存在が予見され、プレエンプティヴ(pre-emptive:予防的)なタンパク質品質管理と命名されました。しかし、ERADなどに代表される小胞体「内」膜タンパク質品質管理とは対照的に、その分子的実体とユビキチンコード作動機構は充分解明されていません。
私たちは、新生ポリペプチドの品質管理を担う新しいプロテアソーム会合因子としてBAG6を見出し、これが不良膜タンパク質のユビキチン化、低分子量GTPase群のユビキチン化などに必須であることを見いだしました。BAG6は、その結合ユビキチンデコーダー群と共に、リボソームから小胞体へのポリペプチド配送を監視するプレエンプティブ品質管理を差配しています。この経路は、凝集性プリオン、あるいは1型糖尿病発症の原因となる変異インシュリン代謝の中核として機能することが、最近の研究から明らかにされました。プレエンプティブ品質管理を標的に、神経変性疾患および1型糖尿病の克服に向けたユビキチン創薬への応用が、現在の課題となっています。
そこで本研究では、ERADに比して研究の歴史が浅いプレエンプティブ品質管理を対象に、基質ユビキチン化の中核を成すBAG6複合体の作動機構を、ケモテクノロジーの手法を用いて解明していきます。特に、BAG6と会合するユビキチンデコーダー群、及びE3ユビキチンリガーゼ群を網羅的に同定し、これらとBAG6との相互作用を選択的に遮断/増強する化合物を同定することによって、プレエンプティヴ品質管理の支配下にある凝集性プリオン、あるいは変異インシュリンの凝集/分解プロセスに与える影響を解明していくことを目指します。
研究概要を示す模式図
本領域での研究成果
- Takahashi T, Minami S, Tajima K, Tsuchiya Y, Sakai N, Suga K, Hisanaga S, Obayashi N, Fukuda M, Kawahara H.
Cytoplasmic control of Rab-family small GTPases through BAG6.
EMBO Rep. 20, e46794 (2019)
PMID: 30804014 - Kamikubo K, Kato H, Kioka H, Yamazaki S, Tsukamoto O, Nishida Y, Asano Y, Imamura H, Kawahara H, Shintani Y, Takashima S.
A molecular triage process mediated by RING finger protein 126 and BCL2-associated athanogene 6 regulates degradation of G0/G1 switch gene 2.
J. Biol. Chem. 294, 14562-14573 (2019)
PMID: 31371451 - Demizu S, Asaka N, Kawahara H, Sasaki E.
TAS-203, an oral phosphodiesterase 4 inhibitor, exerts anti-inflammatory activities in a rat airway inflammation model.
Eur. J. Pharmacol. 849, 22-29 (2019)
PMID: 30716315 - Hayashishita M, Kawahara H, Yokota N.
BAG6 deficiency induces mis-distribution of mitochondrial clusters under depolarization.
FEBS Open Bio 9, 1281-1291 (2019)
PMID: 31125507 - Mimami S, Yokota N, Kawahara H.
BAG6 contributes to glucose uptake by supporting the cell surface translocation of the glucose transporter GLUT4.
Biol. Open 9, bio047324 (2020)
PMID: 31911483 - Matsuura Y, Noguchi A, Yokota N, *Kawahara H.
Nuclear accumulation of ZFP36L1 is cell cycle-dependent and determined by a C-terminal serine-rich cluster.
J. Biochem. 168, 477-489 (2020)
PMID: 32687160
代表的な論文
- Shimada M, Kanematsu K, Tanaka K, Yokosawa H, *Kawahara H.
Proteasomal ubiquitin receptor RPN-10 controls sex determination in Caenorhabditis elegans.
Mol. Biol. Cell 17, 5356-5371 (2006)
PMID: 17050737 - Minami R, Hayakawa A, *Kagawa H, Yanagi Y, Yokosawa H, *Kawahara H.
BAG-6 is essential for selective elimination of defective proteasomal substrates.
J. Cell Biol. 190, 637-650 (2010)
PMID: 20713601 - *Kawahara H, Minami R, Yokota N.
BAG6/BAT3: Emerging roles in quality control for nascent polypeptides.
J. Biochem. 153, 147-160 (2013)
PMID: 23275523 - Suzuki R, *Kawahara H.
UBQLN4 recognizes mislocalized transmembrane domain proteins and targets these to proteasomal degradation.
EMBO Rep. 17, 842–857 (2016)
PMID: 27113755





