伊藤 幸裕
ユビキチン化タンパク質ならびにその連結様式を解析するためのケミカルプローブ創製
 |
研究代表者 伊藤 幸裕大阪大学産業科学研究所複合分子化学研究分野 准教授 |
|---|
研究概要
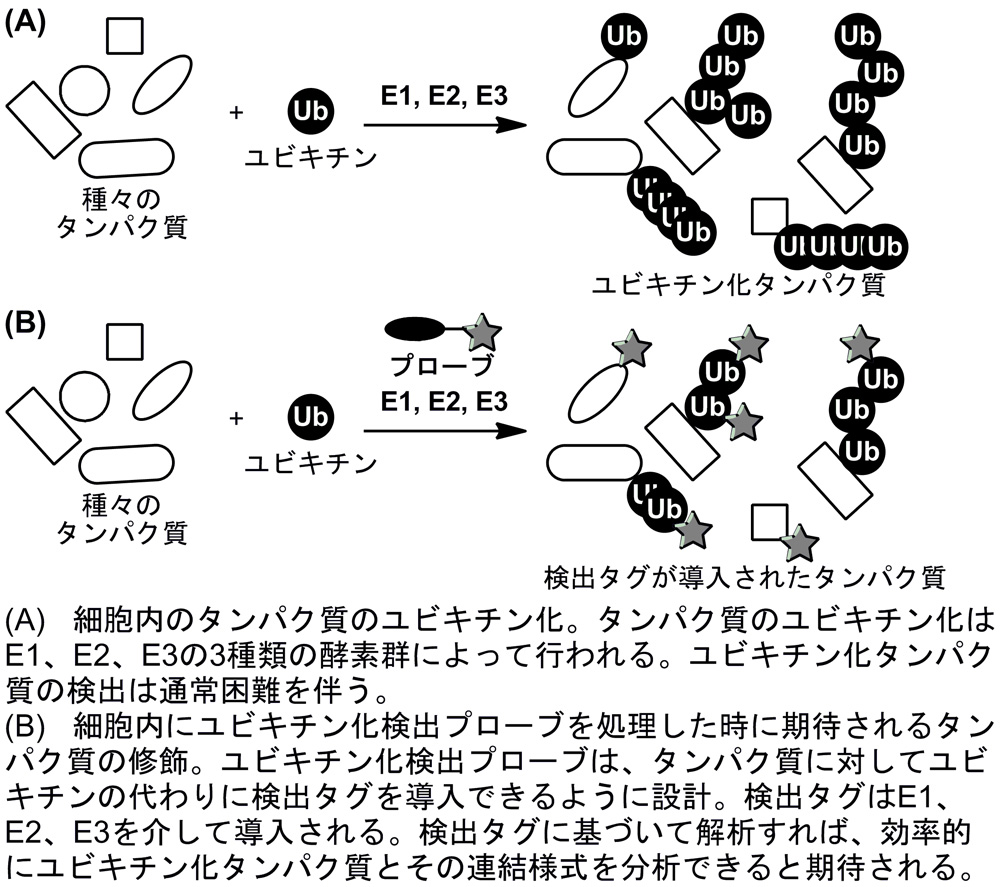
細胞内におけるタンパク質のユビキチン化は、細胞周期の制御や細胞の分化など、多彩な細胞機能調節を司っています。このような多彩な機能調節は、複雑なユビキチン化様式によって達成されると考えられます。ユビキチン化には、モノユビキチン化と8 種類の異なる構造のポリユビキチン鎖修飾が知られており、その上、異なる種類のユビキチン鎖が連結した混合鎖修飾や一つのユビキチンに複数のユビキチン鎖が付加した分岐鎖修飾など複雑なユビキチン修飾も細胞内に存在すると考えられています。すなわち、この多様なユビキチン化様式が、多彩な細胞機能調節を高度に制御していると想定されます。そのため、タンパク質のユビキチン化とその修飾状態が、どのように細胞機能との関係を明らかにすることで、ユビキチン化に関わる生物学の理解につながります。しかし、どのタンパク質のどのリシン残基で、いつ、どのようなユビキチン化修飾を受けるかを検出・定量するのは、通常困難が伴います。以上の背景から、本研究では、細胞内のユビキチン化タンパク質やその修飾状態を簡便かつ効率的に検出するための新たなユビキチン化検出プローブの開発を目指します。
これまでに、私たちは有機化学的アプローチにてユビキチン化を制御する様々な化合物を開発してきました。これらの知見を活かし、ユビキチン化されるタンパク質に対して、ユビキチンの代わりに検出タグを導入できるような化合物をユビキチン化検出プローブとして設計しました(図)。このプローブによって導入される検出タグを目印として利用することで、ユビキチン化タンパク質やそのユビキチン化様式を解析できると期待しています(図)。本研究では、ユビキチン化検出プローブの合成やその構造最適化、プローブとしての機能評価を行います。また、見出されたプローブを利用し、ユビキチン化タンパク質の検出ならびにそのユビキチン化様式の解析を行うことを目指します。
研究概要を示す模式図
本領域での研究成果
- Iida T, *Itoh Y, Takahashi Y, Yamashita Y, Kurohara T, Miyake Y, Oba M, Suzuki T.
Design, Synthesis, and Biological Evaluation of Lysine Demethylase 5 C Degraders.
ChemMedChem AOP (2021)
PMID: 33470543
代表的な論文
- Itoh Y, Ishikawa M, Naito M, *Hashimoto Y.
Protein knockdown using methyl bestatin-ligand hybrid molecules: design and synthesis of inducers of ubiquitination-mediated degradation of cellular retinoic acid-binding proteins.
J. Am. Chem. Soc. 132, 5820-5826 (2010)
PMID: 20369832 - Itoh Y, Ishikawa M, Kitaguchi R, Sato S, Naito M, *Hashimoto Y.
Development of target protein-selective degradation inducer for protein knockdown.
Bioorg. Med. Chem. 19, 3229-3241 (2011)
PMID: 21515062 - Itoh Y, Ishikawa M, Kitaguchi R, Okuhira K, Naito M, *Hashimoto Y.
Double protein knockdown of cIAP1 and CRABP-II using a hybrid molecule consisting of ATRA and IAPs antagonist.
Bioorg. Med. Chem. Lett. 22, 4453-4457 (2012)
PMID: 22658364 - *Itoh Y, Suzuki M.
Design, synthesis, and biological evaluation of novel ubiquitin-activating enzyme inhibitors.
Bioorg. Med. Chem. Lett. 28, 2723-2727 (2018)
PMID: 29548576 - *Itoh Y.
Chemical Protein Degradation Approach and its Application to Epigenetic Targets.
Chem. Rec. 9, 1681-1700 (2018)
PMID: 29893461





