稲田 利文
特異的ユビキチン鎖を標的としたRQC制御の分子基盤の解明
 |
研究代表者 稲田 利文東京大学医科学研究所 教授 |
|---|
研究概要
正確な遺伝子発現は生命現象の根幹であり、その破綻や異常は様々な疾患の原因となる。正確な翻訳伸長反応を保証するシステムとして、細胞は異常な翻訳伸長阻害を認識し排除する品質管理機構を保持しています。研究代表者は、翻訳伸長反応の異常停止が、新生鎖のユビキチン化とプロテアソームによる迅速な分解 (RQC: Ribosome-associated Quality Control) を引き起こすことを見出しました。その後、RQCの初期段階である翻訳伸長中に停滞したリボソームを認識し解離させる分子機構として、リボソームのユビキチン化が必須であることを見出しました。E3ユビキチンライゲースZNF598(酵母HEL2)が翻訳伸長中に停滞したリボソームの特異的な構造を認識し、特定のリボソームタンパク質をユビキチン化することがRQCに必須であること、さらに停滞80Sリボソームをユビキチン化依的に各サブユニットに解離する新規複合体RQT2/3/4を同定しました。我々はuS10のユビキチン化としてK48鎖とK63鎖の両方を同定しましたが、それぞれのユビキチン鎖の機能は未だ不明です。最近我々は、RQCを抑制するE3ユビキチンライゲースを同定した。また、脱ユビキチン化酵素がRQC促進活性を持つことを発見しました。従って本公募研究では、ユビキチン化によるRQCの新規制御機構として、以下の3項目を解析します。
- E3ユビキチンライゲースNOT4によるRQC抑制機構。
NOT4によるuS10のK48鎖のユビキチン化が、RQCに必須なK63鎖のユビキチン化を抑制する可能性を検証する。NOT4とHEL2の、2つのE3ユビキチンライゲースによるuS10のユビキチン化の鎖特異性と、 RQT 複合体依存の解離反応を阻害する分子機構を検証します。 - 脱ユビキチン化酵素によるRQC促進機構の解析。
項目1の解析結果を基盤として、E3依存に形成されたユビキチン鎖を基質とした脱ユビキチン化の効率と、ユビキチン鎖特異性を検証します。uS10に形成されたユビキチン鎖の実体とUBP2とUBP3によるユビキチン鎖長の制御機構を解明します。 - ケモテクノロジーによるRQC制御。
RQCユビキチン修飾やデコーダー分子の特定の機能を瞬時に喪失させることが可能な低分子化合物やステープルペプチドの開発を試みたい。具体的には、①リボソームの鎖特異的ユビキチン化と脱ユビキチン化、②RQT2/3/4複合体による停滞したリボソームの解離反応、を阻害する低分子化合物やステープルペプチドを開発しRQC活性の操作を目指します。
研究概要を示す模式図
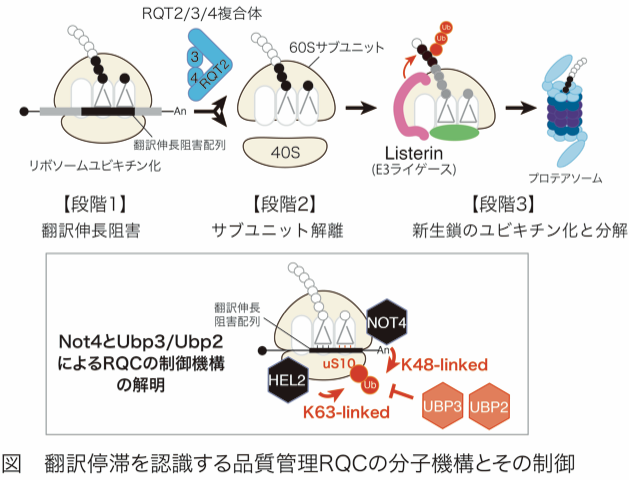
本領域での研究成果
- Yasuda S, Tsuchiya H, Kaiho A, Guo Q, Ikeuchi K, Endo A, Arai N, Ohtake F, Murata S, Inada T, Baumeister W, Fernandez-Busnadiego R, Tanaka K, *Saeki Y.
Stress- and ubiquitylation-dependent phase separation of the proteasome.
Nature 578, 296-300 (2020)
PMID: 32025036
プレスリリース
http://www.igakuken.or.jp/topics/2020/0205.html(都医学研)
https://www.amed.go.jp/news/release_20200206-02.html(AMED)
Highlighted in Cell Res.
EurekAlert!
Faculty Opinions - Matsuo Y, Tesina P, Nakajima S, Mizuno M, Endo A, Buschauer R, Cheng J, Shounai O, Ikeuchi K, Iwasaki S, Saeki Y, Becker T, *Beckmann R, *Inada T.
RQT complex dissociates ribosomes collided on endogenous RQC substrate SDD1.
Nat. Stuct. Mol. Biol. 27, 323-332 (2020)
PMID: 32203490
プレスリリース
https://www.amed.go.jp/news/release_20200324-02.html(AMED)
https://www.tohoku.ac.jp/japanese/2020/03/press20200324-04-honnyaku.html(東北大学)
https://www.nikkei.com/article/DGKKZO57329880X20C20A3MY1000/(日経新聞) -
Buschauer R, Matsuo Y (co-1st author), Sugiyama T, Chen YH, Alhusaini N, Sweet T, Ikeuchi K, Cheng J, Matsuki Y, Gilmozzi A, Berninghausen O, Becker T, *Coller J, *Inada T, *Beckmann R.
The Ccr4-Not complex monitors the translating ribosome for codon optimality.
Science 368, 6448 (2020)
PMID: 32299921
プレスリリース - Hashimoto S, Sugiyama T, Yamazaki R, Nobuta R,*Inada T.
Identification of a novel trigger complex that facilitates ribosome-associated quality control in mammalian cells.
Sci. Rep. 10, 3422(2020)
PMID: 32099016 - Matsuki Y, Matsuo Y, Nakano Y, Iwasaki S, Yoko H, Udagawa T, Li S, Saeki Y, Yoshihisa T, Tanaka K, Ingolia N, *Inada T.
Ribosomal protein S7 ubiquitination during ER stress in yeast is associated with selective mRNA translation and stress outcome.
Sci. Rep. 10, 19669 (2020)
PMID: 33184379 - Udagawa T Seki M, Okuyama T, Adachi S, Natsume T, Noguchi T, Matsuzawa A, *Inada T.
Failure to degrade CAT-tailed proteins disrupts neuronal morphogenesis and cell survival.
Cell Rep. 34, 108599(2021)
PMID: 33406423
プレスリリース
代表的な論文
- Tsuboi T, Kuroha K, Kudo K, Makino S, Inoue E, Kashima I, *Inada T.
Dom34:Hbs1 Plays a General Role in Quality-Control Systems by Dissociation of a Stalled Ribosome at the 3′ End of Aberrant mRNA.
Mol. Cell 46, 518-529 (2012)
PMID: 22503425 - Matsuo Y, Ikeuchi K, Saeki Y, Iwasaki S, Schmidt C, Udagawa T, Sato F, Tsuchiya H, Becker T, Tanaka K, Ingolia NT, Beckmann R, *Inada T.
Ubiquitination of Stalled Ribosome Triggers Ribosome-associated Quality Control.
Nat. Commun. 8, 159 (2017)
PMID: 28757607 - *Inada T.
The ribosome as a platform for mRNA and nascent polypeptide quality control.
Trends Biochem. Sci. 42, 5-15 (2017)
PMID: 27746049 - Ikeuchi K, Tesina P, Matsuo Y, Sugiyama T, Cheng J, Saeki Y, Tanaka K, Becker T, *Beckmann R, *Inada T.
Collided ribosomes form a unique structural interface to induce Hel2‐driven quality control pathways.
EMBO J. 38. e100276 (2019)
PMID: 30609991 - Sugiyama T, Li S, Kato M, Ikeuchi K, Ichimura A, Matsuo Y, *Inada T.
Sequential ubiquitination of ribosomal protein uS3 triggers the degradation of non-functional 18S rRNA.
Cell Rep. 26, 3400-3415.e7 (2019)
PMID: 30893611





