福嶋 俊明
ケモテクノロジーを活用した脱ユビキチン化酵素USP8の作用機構の解明
 |
研究代表者 福嶋 俊明東京工業大学 駒田研究室 助教 |
|---|
研究概要
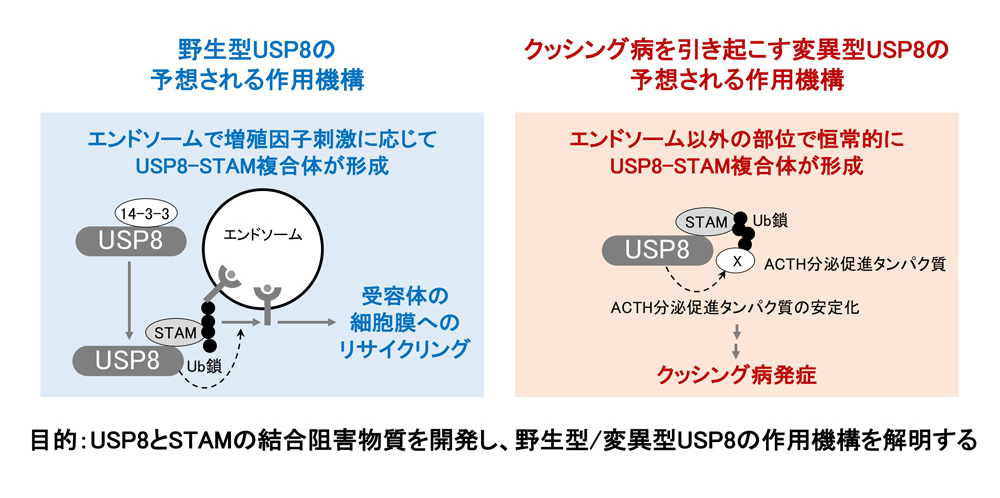
ユビキチン化がエンドサイトーシスの制御に関わることはよく知られています。私たちは、脱ユビキチン化酵素ubiquitin-specific protease 8(USP8)が、EGFRを含む数種の受容体をエンドソーム膜上で脱ユビキチン化し、それらの細胞膜へのリサイクリングを促すことを報告してきました。しかし、USP8を欠損するとエンドサイトーシス経路の機能不全や細胞死が起こるため解析が難しく、受容体エンドサイトーシス・リサイクリングにおけるUSP8の働きは研究分野内で一致した結論が得られていません。また、USP8がどのようなしくみを介してエンドソーム膜上の受容体を効率的に脱ユビキチン化するかは、依然不明です。
USP8は14-3-3結合モチーフとSTAM結合モチーフをもち、これらは互いに近接しています。私たちは、USP8と14-3-3との結合を抑制すると、USP8とSTAMの結合が強まることを最近見出しました。STAMはユビキチン結合タンパク質なので、USP8の基質認識サブユニットとして機能し、脱ユビキチン化反応を促進していると考えられます。私たちは、14-3-3やSTAMとの結合/乖離によってUSP8の活性や細胞内局在が緻密に制御され、エンドソームから細胞膜への受容体の適切なリサイクリングが可能となっていると予想しています。
一方、私たちは、USP8がクッシング病の原因遺伝子であることを発見しました。クッシング病は下垂体から副腎皮質刺激ホルモン(ACTH)が過剰に分泌されることにより、慢性的に副腎皮質ホルモンが高値となり、満月様顔貌・肥満・糖尿病・易感染性などの症状が出る難病で、治療薬はありません。私たちは、約半数のクッシング病患者の下垂体でUSP8遺伝子の特定の領域に体細胞変異が生じていることを見出し、この変異型USP8を発現する細胞は、分子機構は不明ですがACTHを過剰に分泌することを報告しています。
私たちは、クッシング病を引き起こす変異型USP8は14-3-3と結合できず、STAMとは強く結合するようになることを最近見出しました。予備実験の結果から、変異型USP8は恒常的にSTAMと複合体を形成してエンドソームとは異なる部位で活性化し、そこに存在するACTHの分泌を促進するタンパク質を脱ユビキチン化・安定化することにより、疾患の発症を引き起こすと予想しています。
本研究ではSTAMとUSP8の結合阻害物質を開発し、これを活用して適時かつ選択的にUSP8-STAM複合体を乖離することにより、野生型USP8のエンドソーム上での正常な作用機構と、クッシング病を引き起こす変異型USP8の異常な作用機構を明らかにしていきます。
研究概要を示す模式図
本領域での研究成果
- Naito S, *Fukushima T, Endo A, Denda K, *Komada M.
Nik-related kinase is targeted for proteasomal degradation by the chaperone-dependent ubiquitin ligase CHIP.
FEBS Lett. 594, 1778-1786 (2020)
PMID: 32162334
代表的な論文
- Fukushima T, Yoshihara H, Furuta H, Hakuno F, Luan J, Duan C, Saeki Y, Tanaka K, Iemura SI, Natsume T, Chida K, Nakatsu Y, Kamata H, Asano T, *Takahashi SI.
Nedd4-induced monoubiquitination of IRS-2 enhances IGF signaling and mitogenic activity.
Nat. Commun. 6, 6780 (2015)
PMID: 25879670 - *Girnita L, Takahashi SI, Crudden C, Fukushima T, Worrall C, Furuta H, Yoshihara H, Hakuno F, Girnita A.
Chapter Seven - When Phosphorylation Encounters Ubiquitination: A Balanced Perspective on IGF-1R Signaling.
Prog. Mol. Biol. Transl. Sci. 141, 277-311 (2016)
PMID: 27378760 - Furuta H, Yoshihara H, Fukushima T, Yoneyama Y, Ito A, Worrall C, Girnita A, Girnita L, Yoshida M, Asano T, Komada M, Kataoka N, Chida K, Hakuno F, *Takahashi SI.
IRS-2 deubiquitination by USP9X maintains anchorage-independent cell growth via Erk1/2 activation in prostate carcinoma cell line.
Oncotarget. 9, 33871-33883 (2018)
PMID: 30338032 - Xie X, Matsumoto S, Endo A, *Fukushima T, Kawahara H, Saeki Y, *Komada M.
Deubiquitylases USP5 and USP13 are recruited to and regulate heat-induced stress granules through their deubiquitylating activities.
J. Cell Sci. 131, jcs210856 (2018)
PMID: 29567855 - Kawaguchi K, Endo A, *Fukushima T, Madoka Y, Tanaka T, *Komada M.
Ubiquitin-specific protease 8 deubiquitinates Sec31A and decreases large COPII carriers and collagen IV secretion.
Biochem. Biophys. Res. Commun. 499, 635-641 (2018)
PMID: 29604273 - Sakai R, Fukuda R, Unida S, Aki M, Ono Y, Endo A, Kusumi S, Koga D, Fukushima T, Komada M, *Okiyoneda T.
The integral function of the endocytic recycling compartment is regulated by RFFL-mediated ubiquitylation of Rab11 effectors.
J. Cell Sci. 132, jcs228007 (2019)
PMID: 30659120





