有井 潤
ユビキチンテクノロジーの創出によるウイルス出芽の解剖
 |
研究代表者 有井 潤神戸大学大学院医学研究科 附属感染症センター 臨床ウイルス学分野 准教授
|
|---|
研究概要
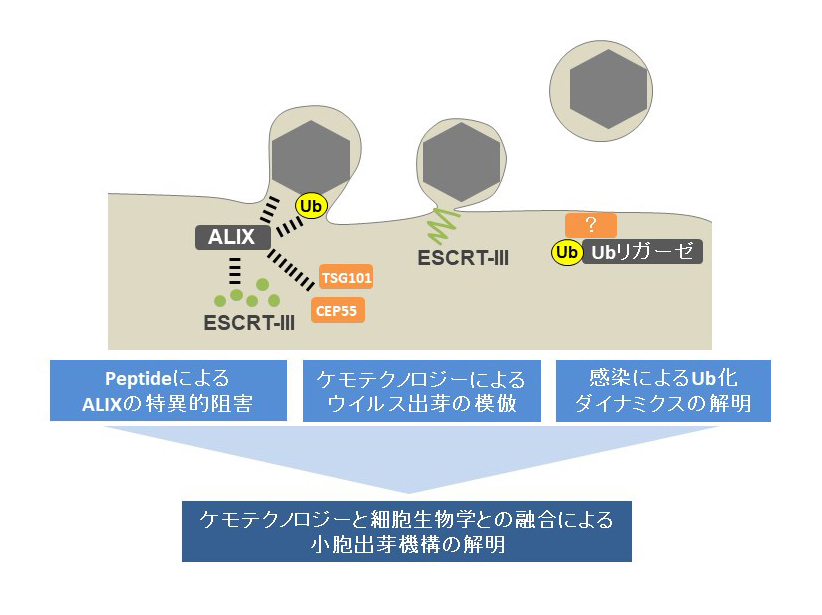
膜タンパク質へのユビキチン(Ub)化は、ESCRT-III機構を活性化することで膜切断を引き起こし、小胞出芽を誘導すると考えられています。多くのエンベロープウイルスが細胞から脱出するときにも、このシステムを模倣し、ALIXなどのESCRTタンパク質を介して膜切断が引き起こされます。ALIXはUb鎖を認識することが知られていますが、小胞の積荷タンパク質を直接結合する例も多数存在します。さらにALIXは、細胞分裂を含めたさまざまな機能を司ることが知られています。このため、実際に積荷タンパク質自身に対するUb化が直接ESCRT-IIIによる膜切断を誘導している証拠はほとんどありません。
ヘルペスウイルスは、ヒトに脳炎を始めとした多彩な病態を引き起こす医学上極めて重要なウイルスです。このウイルスは、宿主に終生続く潜伏感染を成立させることができ、ストレスなどをきっかけとして再活性化を引き起こすため、度々病態を繰り返すことがあります。このため、人類のほぼ全てが、複数のヘルペスウイルスに感染していると推定されています。つまり、ほぼ全ての人間は、ヘルペスウイルスが引き起こす病態と無縁ではいられないといえます。Ub関連創薬が発展しつつある現在において、ヒトに常在するヘルペスウイルスとUbとの関係を再検討する必要があるのではないでしょうか?
またヘルペスウイルスは、核内膜と細胞質内小胞という、ユニークな場所で出芽を引き起こすことが知られています。さらにこのウイルスは、自らUbリガーゼと脱Ub化酵素をコードしてます。これらのことを鑑みると、ヘルペスウイルス感染細胞におけるUb化状態を包括的に理解しなければ、その出芽におけるUb化の意義を知ることができないと考えられます。
本研究では、ユビキチンテクノロジーを創出し、駆使することで、ヘルペスウイルスの出芽機構の理解と制御を目指します。また、本研究で注目するESCRT-IIIは、多くのウイルスの増殖に必須の宿主機構です。これらを対象としたケモテクノロジーの創出は、広範囲に効果のある抗ウイルス剤の開発にも貢献すると考えられます。
研究概要を示す模式図
本領域での研究成果
- Arii J, Takeshima K, Maruzuru Y, Koyanagi N, Kato A, Kawaguchi Y.
Roles of the interhexamer Contact Site for Hexagonal Lattice Formation of the Herpes Simplex Virus 1 Nuclear Egress Complex in Viral Primary Envelopment and Replication.
J. Virol. 93, e00498-19 (2019)
PMID: 31043535 - Takeshima K, Arii J (contributed equally), Maruzuru Y, Koyanagi N, Kato A, Kawaguchi Y.
Identification of the Capsid Binding Site in the Herpes Simplex Virus 1 Nuclear Egress Complex and Its Role in Viral Primary Envelopment and Replication.
J. Virol. 93, e01290-19 (2019)
PMID: 31391274 - Arii J, Maeda F, Maruzuru Y, Koyanagi N, Kato A, Mori Y, Kawaguchi Y.
ESCRT-III controls nuclear envelope deformation induced by progerin.
Sci. Rep. 10, 18877 (2020)
PMID: 33139753 - Arii J, Fukui A, Shimanaka Y, Kono N, Arai H, Maruzuru Y, Koyanagi N, Kato A, Mori Y, Y Kawaguchi.
Role of phosphatidyl-ethanolamine biosynthesis in herpes simplex virus 1 infected cells on progeny virus morphogenesis in the cytoplasm and on viral pathogenicity in vivo.
J. Virol. 94, e01572-20 (2020)
PMID: 32999028 - *Watanabe M, *Arii J, Takeshima K, Fukui A, Shimojima M, Kozuka-Hata H, Oyama M, Minamitani T, Yasui T, Kubota Y, Takekawa M, Kosugi I, Maruzuru Y, Koyanagi N, Kato A, Mori Y, Kawaguchi Y.
Prohibitin-1 contributes to the cell-to-cell transmission of herpes simplex virus 1 via the MAPK/ERK signaling pathway.
J. Virol. 95, e01413-20 (* contributed equally) (2021)
PMID: 33177205
代表的な論文
- Arii J, Goto H, Suenaga T, Oyama M, Kozuka-Hata H, Imai T, Minowa A, Akashi H, Arase H, Kawaoka Y, *Kawaguchi Y.
Non-muscle myosin IIA is a functional entry receptor for herpes simplex virus 1.
Nature 467, 859-862 (2010)
PMID: 20944748 - Arii J, Hirohata Y, Kato A, *Kawaguchi Y.
Nonmuscle Myosin Heavy Chain IIB Mediates Herpes Simplex Virus 1 Entry.
J. Virol. 89, 1879-1888 (2015)
PMID: 25428876 - Arii J, Shindo K, Koyanagi N, Kato A, *Kawaguchi Y.
Multiple Roles of the Cytoplasmic Domain of Herpes Simplex Virus 1 Envelope Glycoprotein D in Infected Cells.
J. Virol. 90, 10170-10181 (2016)
PMID: 27581980 - Arii J, Watanabe M, Maeda F, Tokai-Nishizumi N, Chihara T, Miura M, Maruzuru Y, Koyanagi N, Kato A, *Kawaguchi Y.
ESCRT-III mediates budding across the inner nuclear membrane and regulates its integrity.
Nat. Commun. 9, 3379 (2018)
PMID: 30139939 - *Arii J, Kawaguchi Y.
The Role of HSV Glycoproteins in Mediating Cell Entry.
Adv. Exp. Med. Biol. 1045, 3-21 (2018)
PMID: 29896660





