ユビキチン酵素標的を網羅的に探索する革新的技術基盤の確立

研究概要:
ユビキチン介在性のタンパク質分解機構は、さまざまなシグナル伝達因子や細胞周期制御因子などの量的制御を司っており、広範な生命現象への関与が示されている。ヒトゲノム情報の解読により、基質特異性を決定する酵素であるユビキチンリガーゼ (E3) が600種類以上存在することが示されたが、個々のE3が標的とする基質分子はほとんど未同定のままであり、この酵素-基質関係の網羅的解明はユビキチン化が如何にして生命現象を制御するかを知る上で極めて本質的である。
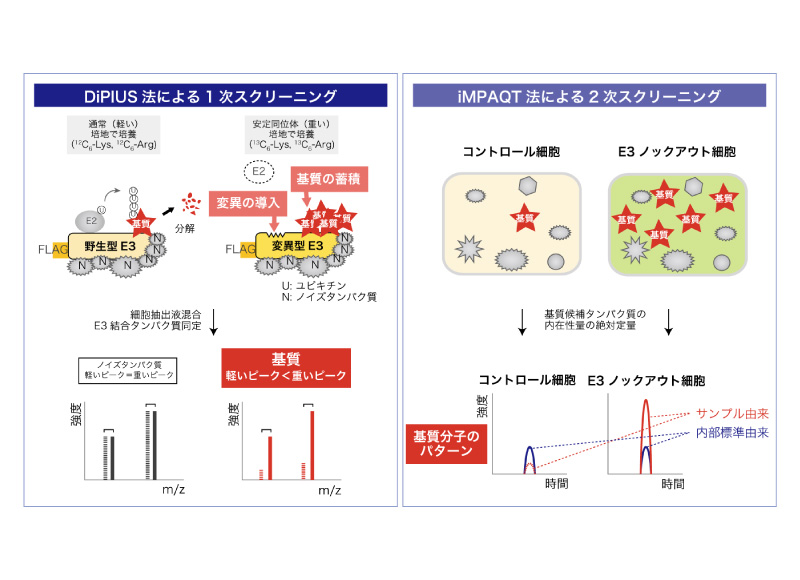
本研究では、分解シグナルを付加するユビキチンリガーゼの基質を生理的条件下で包括的に同定できる研究基盤を構築することを目標とする。本研究に先駆け、われわれは高感度質量分析計を用いた2つの手法、DiPIUS法およびiMPAQT法を開発した。本方法の組み合わせにより高精度で同定された新規基質を手掛かりに、遺伝学的知見や発生工学的手法と組み合わせて、ユビキチンリガーゼの生物学的機能を解き明かす。本研究の達成によって、個々のE3の生物学的機能の理解が深まるだけでなく、ユビキチンネットワークの全貌が判明することにより、多様な生体機能分子の量的・質的制御メカニズム解明の飛躍的な促進が期待される。
関連する代表的な論文:
- Yumimoto, K. and Nakayama, K.I. Fbxw7 suppresses cancer metastasis by inhibiting niche formation. Oncoimmunology, in press
- Nakajima, T., Kitagawa, K., Ohhata, T., Sakai, S., Uchida, C., Shibata, K., Minegishi, N., Yumimoto, K., Nakayama, K.I., Masumoto, K., Katou, F., Niida, H., and Kitagawa, M. (2015) Regulation of GATA-binding protein 2 levels via ubiquitin-dependent degradation by Fbw7: involvement of cyclin B-cyclin-dependent kinase 1-mediated phosphorylation of Thr176 in GATA-binding protein 2. J. Biol. Chem. 290, 10368-10381.
- Yumimoto, K., Akiyoshi, S., Ueo, H., Sagara, Y., Onoyama, I., Ueo, H., Ohno, S., Mori, M., Mimori, K., and Nakayama, K.I. (2015) Fbxw7 inhibits cancer metastasis in a non-cell-autonomous manner. J. Clin. Invest. 125, 621-635.
- Yamauchi, T., Nishiyama, M., Moroishi, T., Yumimoto, K., and Nakayama, K.I. (2014) MDM2 mediates nonproteolytic polyubiquitylation of the DEAD-Box RNA helicase DDX24. Mol. Cell. Biol. 34, 3321-3340.
- Yumimoto, K., Muneoka, T., Tsuboi, T., and Nakayama, K.I. (2013) Substrate binding promotes formation of the Skp1-Cul1-Fbxl3 (SCF(Fbxl3)) protein complex. J. Biol. Chem. 288, 32766-32776.
- Yumimoto, K., Matsumoto, M., Onoyama, I., Imaizumi, K., and Nakayama, K.I. (2013) F-box and WD repeat domain-containing-7 (Fbxw7) protein targets endoplasmic reticulum-anchored osteogenic and chondrogenic transcriptional factors for degradation. J. Biol. Chem. 288, 28488-28502.
- Hirano, A., Yumimoto, K., Tsunematsu, R., Matsumoto, M., Oyama, M., Kozuka-Hata, H., Nakagawa, T., Lanjakornsiripan, D., Nakayama, K.I., and Fukada, Y. (2013) FBXL21 regulates oscillation of the circadian clock through ubiquitination and stabilization of cryptochromes. Cell 152, 1106-1118.
- Okita, Y., Matsumoto, A., Yumimoto, K., Isoshita, R., and Nakayama, K.I. (2012) Increased efficiency in the generation of induced pluripotent stem cells by Fbxw7 ablation. Genes Cells 17, 768-777.
- Yumimoto, K., Matsumoto, M., Oyamada, K., Moroishi, T., and Nakayama, K.I. (2012) Comprehensive identification of substrates for F-box proteins by differential proteomics analysis. J. Proteome Res., 11, 3175-3185.