ユビキチン修飾系による膜タンパク質の
輸送制御機構


研究概要:
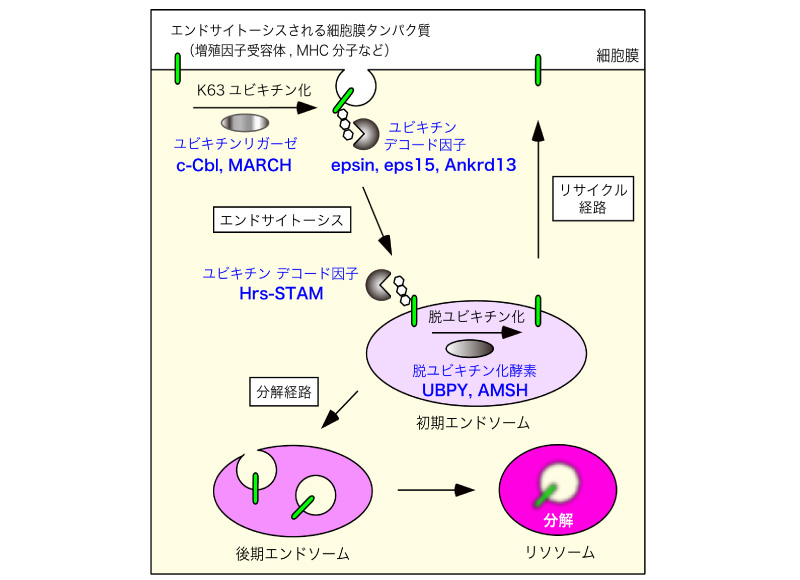
細胞膜タンパク質の発現レベルは細胞のおかれた状況に応じてそれぞれ適切に調節されており、その破綻は腫瘍(e.g., 増殖因子受容体の場合)や免疫疾患(e.g., MHC分子の場合)などの様々な病態につながります。その発現量をコントロールするため、細胞は分解すべき細胞膜タンパク質をエンドサイトーシスにより取り込み、エンドソームを経てリソソームに輸送して分解します。ユビキチン化修飾(主にK63ポリユビキチン化)は、分解すべき細胞膜タンパク質だけを選択的にリソソームに輸送するためのシグナル(荷札)として働いています。
本研究では、ユビキチン化修飾(ユビキチンコード)による細胞膜タンパク質のリソソームへの輸送の制御機構、すなわちこのプロセスを制御するユビキチンリガーゼ、脱ユビキチン化酵素、およびそのユビキチンコードを識別するタンパク質(デコード因子)の同定と、それらタンパク質の選択的ユビキチン鎖識別機構の解明を行います。さらに、それら制御タンパク質の機能の破綻の腫瘍性疾患・免疫性疾患への関与を解析し、基礎的な細胞生物学の研究成果を医療・社会に還元します。
関連する代表的な論文:
(駒田)
- Reincke, M., Sbiera, S., Hayakawa, A., Theodoropoulou, M., Osswald, A., Beuschlein, F., Meitinger, T., Mizuno-Yamasaki, E., Kawaguchi, K., Saeki, Y., Tanaka, K., Wieland, T., Graf, E., Saeger, W., Ronchi, C.L., Allolio, B., Buchfelder, M., Strom, T.M., Fassnacht, M., and Komada, M. (2015) Mutations in the deubiquitinase gene USP8 cause Cushing's disease. Nat. Genet. (Article) 47, 31-38.
- Perez-Rivas, L.G., Theodoropoulou, M., Ferraù, F., Nusser, C., Kawaguchi, K., Stratakis, C., Faucz, F.R., Wildemberg, L.E., Assié, G., Beschorner, R., Dimopoulou, C., Buchfelder, M., Popovic, V., Berr, C., Toth, M.I., Ardisasmita, A.I., Honegger, J,. Bertherat, J., Gadelha, M.R., Beuschlein, F., Stalla, G., Komada, M., Korbonits, M., and Reincke, M. (2015) The gene of the ubiquitin-specific protease 8 is frequently mutated in adenomas causing Cushing's disease. J. Clin. Endocrinol. Metab., doi:org/10.1210/jc.2015-1453.
- Theodoropoulou, M., Reincke, M., Fassnacht, M., and Komada, M. (2015) Decoding the genetic basis of Cushing's disease: USP8 in the spotlight. Eur. J. Endorinol., doi:10.1530/EJE-15-0320.
- Sun, X.X., He, X., Yin, L., Komada, M., Sears, R.C., and Dai, M.S. (2015) The nucleolar ubiquitin-specific protease USP36 deubiquitinates and stabilizes c-Myc. Proc. Natl. Acad. Sci. USA 112, 3734-3739.
- Tanno, H., Shigematsu, T., Nishikawa, S., Hayakawa, A., Denda, K., Tanaka, T., and Komada, M. (2014) Ubiquitin-interacting motifs confer full catalytic activity, but not ubiquitin chain substrate specificity, to deubiquitinating enzyme USP37. J. Biol. Chem. 289, 2415-2423.
(石戸)
- Ishikawa, R., Kajikawa, M., and Ishido, S. (2014) Loss of MHC II ubiquitination inhibits the activation and differentiation of CD4 T cells. Int. Immunol. 26, 283-289.
- Li, P.C., Miyashita, N., Im, W., Ishido, S., and Sugita, Y. (2014) Multidimensional umbrella sampling and replica-exchange molecular dynamics simulations for structure prediction of transmembrane helix dimers. J. Comput. Chem. 35, 300-308.
- Oh, J., Wu, N., Baravalle, G., Cohn, B., Ma, J., Lo, B., Mellman, I., Ishido, S., Anderson, M., and Shin, J.S. (2013) MARCH1-mediated MHCII ubiquitination promotes dendritic cell selection of natural regulatory T cells. J. Exp. Med. 210, 1069-1077.
- Furuta, K., Ishido, S., and Roche, P.A. (2012) Encounter with antigen-specific promoted CD4 cells promotes MHC class II degradation in dendritic cells. Proc. Natl. Acad. Sci. USA 109, 19380-19385.
- Kajikawa, M., Li, P.C., Goto, E., Miyashita, N, Aoki-Kawasumi, M., Mito-Yoshida, M., Ikegaya, M., Sugita, Y., and Ishido, S. (2012) The inter-transmembrane region of KSHV MIR2 contributes to B7-2 downregulation. J. Virol. 86, 5288-5296.