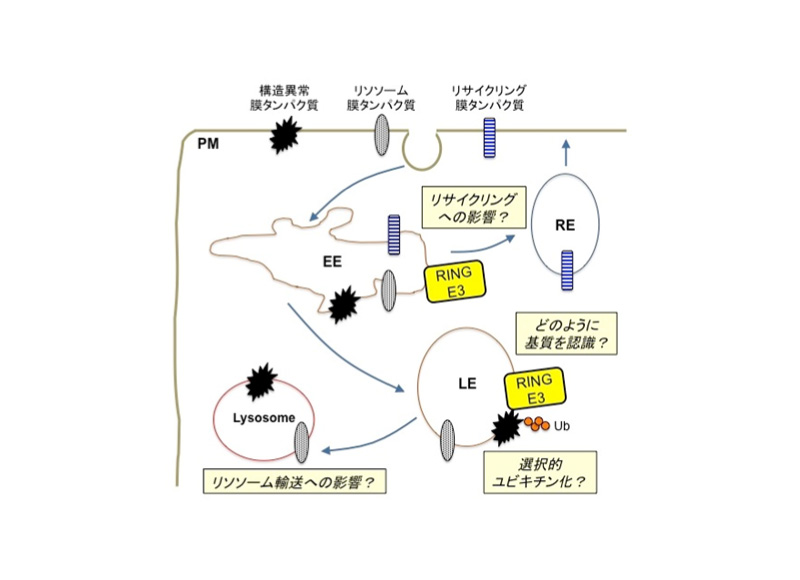
エンドソーム膜タンパク質品質管理におけるE3リガーゼの役割

研究代表者:
沖米田 司
(関西学院大学・理工学部 生命医化学科 准教授)
研究室HP:
http://sci-tech.ksc.kwansei.ac.jp/~okiyoneda/okilab.html研究概要:
遺伝子変異やストレスにより生じる異常膜タンパク質は、主に小胞体品質管理機構によりユビキチン化され、小胞体関連分解されます。一方、形質膜で傷害を受けて生じた異常膜タンパク質や、小胞体品質管理から逃れて形質膜に発現した異常膜タンパク質は、形質膜タンパク質品質管理機構によりユビキチン化を受け、エンドサイトーシスの後にリソソーム分解されます。我々は嚢胞性線維症に関わる塩素イオンチャネルCFTR ΔF508変異体をモデルタンパク質として、形質膜タンパク質品質管理におけるユビキチン化機構の解析を行い、形質膜の構造異常膜タンパク質は分子シャペロン結合型ユビキチンリガーゼCHIPにユビキチン化されることで、速やかに形質膜から除去されることを明らかにしてきました。本研究では、網羅的siRNAスクリーニングにより同定したエンドソーム局在ユビキチンリガーゼによる異常膜タンパク質品質管理機構の解析を進め、さらに、エンドソーム局在ユビキチンリガーゼの生理機能についても解析を進めます。
関連する代表的な論文:
- Apaja, P.M., Foo, B., Okiyoneda, T., Valinsky, W.C., Barriere, H., Atanasiu, R., Ficker, E., Lukacs, G.L., and Shrier, A. (2013) Ubiquitination-dependent quality control of hERG K+ channel with acquired and inherited conformational defect at the plasma membrane. Mol. Biol. Cell 24, 3787-804.
- Okiyoneda, T., Veit, G., Dekkers, J.F., Bagdany, M., Soya, N., Xu, H., Roldan, A., Verkman, A.S., Kurth, M., Simon, A., Hegedus, T., Beekman, J.M., and Lukacs, G.L. (2013) Mechanism-based corrector combination restores ΔF508-CFTR folding and function. Nat. Chem. Biol. 7, 444-454.
- Okiyoneda, T. and Lukacs, G.L. (2012) Fixing cystic fibrosis by correcting CFTR domain assembly. J. Cell Biol. 199, 199-204.
- Sato, T., Sako, Y., Sho, M., Momohara, M., Suico, M.A., Shuto, T., Nishitoh, H., Okiyoneda, T., Kokame, K., Kaneko, M., Taura, M., Miyata, M., Chosa, K., Koga, T., Morino-Koga, S., Wada, I., and Kai, H. (2012) STT3B-dependent posttranslational N-glycosylation as a surveillance system for secretory protein. Mol. Cell 47, 99-110.
- Rabeh, W.M., Bossard, F., Xu, H., Okiyoneda, T., Bagdany, M., Mulvihill, C.M., Du, K., di Bernardo, S., Liu, Y., Konermann, L., Roldan, A., and Lukacs, G.L. (2012) Correction of both NBD1 energetics and domain interface is required to restore ΔF508 CFTR folding and function. Cell 148, 150-63.
- Okiyoneda, T., Apaja, P.M., and Lukacs, G.L. (2011) Protein quality control at the plasma membrane. Curr. Opin. Cell Biol. 23, 483-491.
- Okiyoneda, T., Barrière, H., Bagdány, M., Rabeh, W.M., Du, K., Höhfeld, J., Young, J.C., and Lukacs, G.L. (2010) Peripheral protein quality control removes unfolded CFTR from the plasma membrane. Science 329, 805-810.
- Hutt, D.M., Herman, D., Rodrigues, A.P., Noel, S., Pilewski, J.M., Matteson, J., Hoch, B., Kellner, W., Kelly, J.W., Schmidt, A., Thomas, P.J., Matsumura, Y., Skach, W.R., Gentzsch, M., Riordan, J.R., Sorscher, E.J., Okiyoneda, T., Yates, J.R. 3rd, Lukacs, G.L., Frizzell, R.A., Manning, G., Gottesfeld, J.M., and Balch, W.E. (2010) Reduced histone deacetylase 7 activity restores function to misfolded CFTR in cystic fibrosis. Nat. Chem. Biol. 6, 25-33.
- Glozman, R., Okiyoneda, T. (equal contribution), Mulvihill, C.M., Rini, J.M., Barriere, H., and Lukacs, G.L. (2009) N-glycans are direct determinants of CFTR folding and stability in secretory and endocytic membrane traffic. J. Cell Biol. 184, 847-862.