ユビキチン付加を選択的に誘導する新規翻訳後修飾

研究代表者:
有本 博一
(東北大学・大学院生命科学研究科 教授)
研究室HP:
http://www.lifesci.tohoku.ac.jp/research/analytical_biooganic/研究概要:
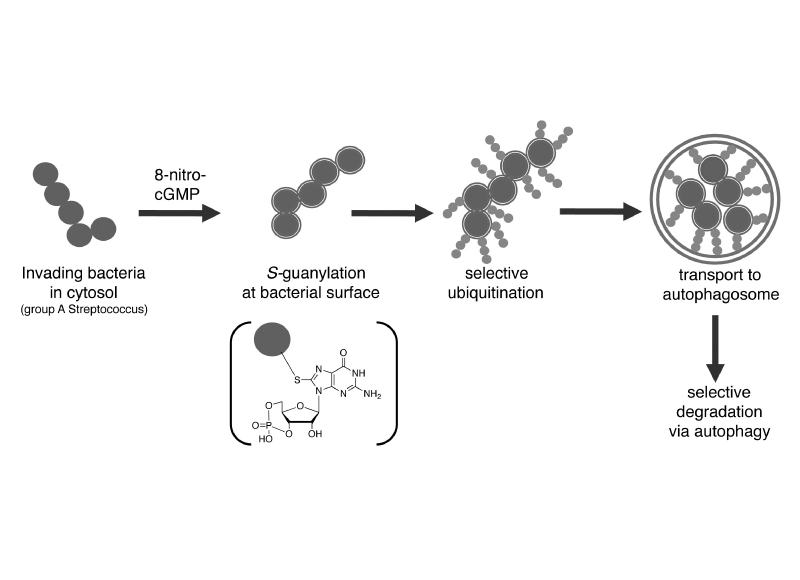
「選択的オートファジー」におけるcargo選択の目印としてポリユビキチン鎖の役割が注目されている。例えば、細胞質に侵入した細菌は、オートファジー分解を受ける前に多くがユビキチン鎖付加を受ける。私達は、A群連鎖球菌周囲の翻訳後修飾が、Lys63型ユビキチン鎖付加の引き金となるという結果を得た(2013年)。この翻訳後修飾(S-グアニル化)は、8−ニトロcGMPとシステイン残基との間で起こる修飾反応として2007年に初めて報告されている。8−ニトロcGMPは、一酸化窒素NOと活性酸素に直接由来していることから、炎症や感染症などとの深い関わりが予想されている。
申請にあたり予備検討を行なったところ、タンパク質S-グアニル化は、細菌感染系以外でも同様にユビキチン鎖集積を引き起こし、S-グアニル化修飾されたタンパク質は選択的にオートファジーで分解された。S-グアニル化修飾を直接認識するユビキチンリガーゼの存在に興味が持たれる。本領域の研究者と協力して、メカニズムの解明を進めたい。
S-グアニル化を特定のタンパク質に導入できれば、狙った対象を狙ったタイミングで自在に分解する手法となる可能性がある、疾患の治療にも応用が期待できる。
関連する代表的な論文:
- Ito, C., Saito, Y., Nozawa, T., Fujii, S., Sawa, T., Inoue, H., Matsunaga, T., Khan, S., Akashi, S., Hashimoto, R., Aikawa, C., Takahashi, E., Sagara, H., Komatsu, M., Tanaka, K., Akaike, T., Nakagawa, I., and Arimoto, H. (2013) Endogenous Nitrated Nucleotide Is a Key Mediator of Autophagy and Innate Defense against Bacteria. Mol. Cell 52, 794-804.
- Saito, Y., Sawa, T., Yoshitake, J., Ito, C., Fujii, S., Akaike, T., and Arimoto, H. (2012) Nitric oxide promotes recycling of 8-nitro-cGMP, a cytoprotective mediator, into intact cGMP in cells. Mol. BioSyst. 8, 2909-2915.
- Saito, Y., Ito, C., Fujii, S., Sawa, T., Akaike, T., and Arimoto, H. (2013) Fluorescent probes for live cell imaging of endogenous guanine nitration. ChemBioChem 14, 1068-1071.
- Sawa, T., Zaki, M.H., Okamoto, T., Akuta, T., Tokutomi, Y., Mitsuyama, S.K.-, Ihara, H., Kobayashi, A., Yamamoto, M., Fujii, S., Arimoto, H., and Akaike, T. (2007) Protein S-guanylation by the biological signal 8-nitroguanosine 3',5'-cyclicmonophosphate. Nat. Chem. Biol. 3, 727-735.