翻訳後修飾因子の翻訳後修飾:リン酸化ユビキチンの細胞内機能の解析

研究概要:
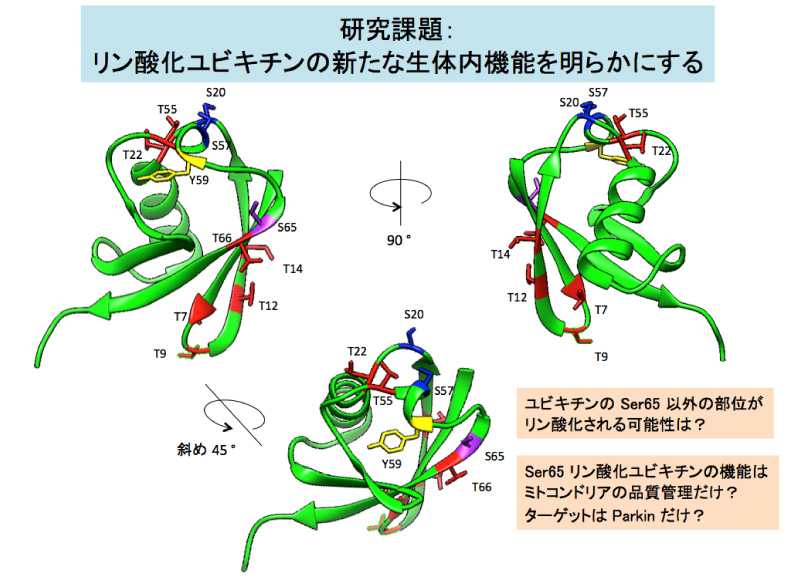
我々は「遺伝性劣性パーキンソン病(PD)の原因遺伝子産物(PINK1,Parkin)とユビキチンが連携して働いて、細胞内のミトコンドリア品質を維持する」プロセスの研究を続けてきました。そして PINK1 と Parkin の分子機構を詳細に解析する過程で、(1) PINK1 がユビキチンの Ser65 をリン酸化すること、(2) Ser65 リン酸化ユビキチンが Parkin の活性化因子として機能すること、(3) Ser65 リン酸化ユビキチン鎖が損傷ミトコンドリア上の Parkin 受容体であること、を見出しました(Nature 2014; JCB 2015)。修飾因子であるユビキチン自身がリン酸化修飾を受け、それが遺伝性 PD の発症を防ぐのに重要だという知見は、研究を始めた当初には全く予想しなかった展開でした。国内外の研究グループからも追試論文が報告されており、この'意外な結論'の信頼度は高いと思っています。
一方で、この知見は新たな疑問を想起するものでもあります。特に『ユビキチンのリン酸化は、ミトコンドリア品質管理以外のプロセスでは使用されないのか』という点は興味深いです。採択研究期間中に、ユビキチンリン酸化の細胞内機能をより深く解析することで、この謎に迫りたいと考えています。
関連する代表的な論文:
- Okatsu, K., Koyano, F., Kimura, M., Kosako, H., Saeki, Y., Tanaka, K., and Matsuda, N. (2015) Phosphorylated ubiquitin chain is the genuine Parkin receptor. J. Cell Biol. 209, 111-128.
- Okatsu, K., Kimura, M., Oka, T., Tanaka, K., and Matsuda, N. (2015) Unconventional PINK1 localization mechanism to the outer membrane of depolarized mitochondria drives Parkin recruitment. J. Cell Sci. 128, 964–978.
- Koyano, F., Okatsu, K., Kosako, H., Tamura, Y., Go, E., Kimura, M., Kimura, Y., Tsuchiya, H., Yoshihara, H., Hirokawa, T., Endo, T., Fon, E-A., Trempe, J-F., Saeki, Y., Tanaka, K., and Matsuda, N. (2014) Ubiquitin is phosphorylated by PINK1 to activate Parkin. Nature 510, 162–166.
- Okatsu, K., Uno, M., Koyano, F., Go, E., Kimura, M., Oka, T., Tanaka, K., and Matsuda, N. (2013) A dimeric PINK1-containing complex on depolarized mitochondria stimulates Parkin recruitment. J. Biol. Chem. 288, 36372-36384.
- Iguchi, M., Kujuro, Y., Okatsu, K., Koyano, F., Kimura, M., Suzuki, N., Uchiyama, S., Tanaka, K., and Matsuda, N. (2013) Parkin catalyzed ubiquitin-ester transfer is triggered by PINK1-dependent phosphorylation. J. Biol. Chem. 288, 22019-22032.
- Koyano, F., Okatsu, K., Ishigaki, S., Fujioka, Y., Kimura, M., Sobue, G., Tanaka, K., and Matsuda, N. (2013) The principal PINK1 and Parkin cellular events triggered in response to dissipation of mitochondrial membrane potential occur in primary neurons. Genes Cells 18, 672-681.
- Okatsu, K., Iemura, S-I., Koyano, F., Go, E., Kimura, M., Natsume, T., Tanaka, K., and Matsuda, N. (2012) Mitochondrial hexokinase HKI is a novel substrate of the Parkin ubiquitin ligase. Biochem. Biophys. Res. Commun. 428, 197-202.
- Okatsu, K., Oka, T., Iguchi, M., Imamura, K., Kosako, H., Tani, N., Kimura, M., Go, E., Koyano, F., Funayama, M., Shiba-Fukushima, K., Sato, S., Shimizu, H., Fukunaga, Y., Taniguchi, H., Komatsu, M., Hattori, N., Mihara, K., Tanaka, K., and Matsuda, N. (2012) PINK1 autophosphorylation upon membrane potential dissipation is essential for Parkin recruitment to damaged mitochondria. Nat. Commun. 3, 1016
- Okatsu, K., Saisho, K., Shimanuki, M., Nakada, K., Shitara, H., Sou, Y-S., Kimura, M., Sato, S., Hattori, N., Komatsu, M., Tanaka, K. and Matsuda, N. (2010) p62/SQSTM1 cooperates with Parkin for perinuclear clustering of depolarized mitochondria. Genes Cells 15, 887-900.
- Matsuda, N., Sato, S., Shiba, K., Okatsu, K., Saisho, K., Gautier, C., Sou, Y-S., Saiki, S., Kawajiri, S., Sato, F., Kimura, M., Komatsu, M., Hattori, N., and Tanaka, K. (2010) PINK1 stabilized by mitochondrial depolarization recruits Parkin to damaged mitochondria and activates latent Parkin for mitophagy. J. Cell Biol. 189, 211-221.