バクテリアが利用するユビキチンシステム

研究代表者:
金 玟秀
(京都大学・白眉センター 特定准教授)
研究室HP:
準備中研究概要:
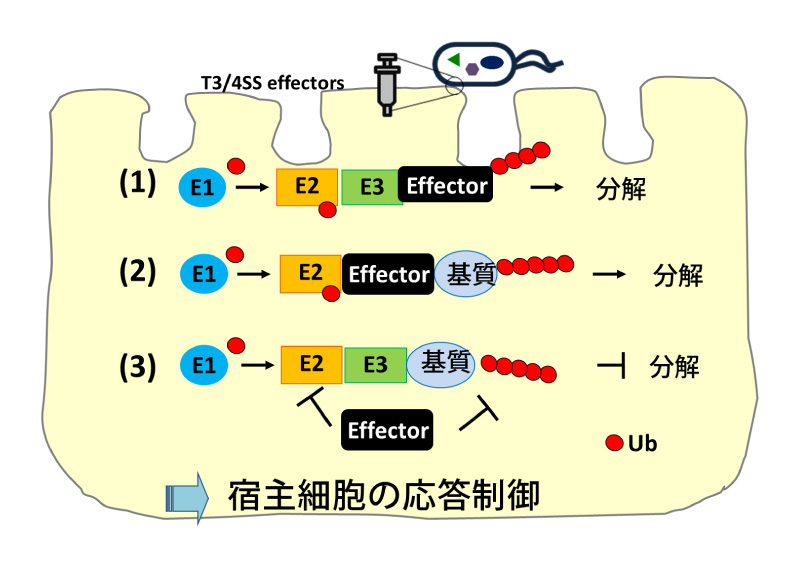
病原性大腸菌を含む腸管病原細菌は近年、多剤耐性菌による感染症例が増加し、有効なワクチンも未開発のため、既存の抗生剤とは作用機序が異なる新しいコンセプトの治療薬の開発が望まれている。ユビキチン修飾系は高次生命現象やヒト疾患の理解に不可欠な要素である。近年、病原細菌やウイルスによる感染症においても、ユビキチン修飾系が重要な役割を果たすことが明らかになってきた。我々は腸管病原細菌の病原因子の解析を進め、ユビキチン修飾系に関わる病原因子を発見した。これらの病原因子は大きく (1) ユビキチン修飾系の酵素活性を持つ分子(E3 ユビキチンリガーゼ)、(2) 宿主細胞内でユビキチン化・分解を受ける基質分子、(3) 宿主のユビキチン修飾系を制御する分子に分けられるが、これらの病原因子について、感染成立における生理機能や作用機序はまだわからないものが多く存在する。本研究では、腸管病原細菌感染において、病原細菌側と宿主側の各々が有するユビキチン修飾システムが果たす役割を明らかにし、その成果をもとに腸管病原細菌に対する治療薬の開発を目指す。
関連する代表的な論文:
- Kim, M., Otsubo, R., Morikawa, H., Nishide, A., Takagi, K., Sasakawa, C., and Mizushima, T. (2014) Bacterial effectors and their functions in the ubiquitin-proteasome system: insight from the modes of substrate recognition. Cells 3, 848-864
- Nishide, A., Kim, M., Takagi, K., Himeno, A., Sanada, T., Sasakawa, C., and Mizushima, T. (2013) Structural basis for the recognition of Ubc13 by the Shigella flexneri effector OspI. J. Mol. Biol. 425, 2623-2631.
- Sanada, T., Kim, M., Mimuro, H., Suzuki, M., Ogawa, M., Oyama, A., Ashida, H., Kobayashi, T., Koyama, T., Nagai, S., Shibata, Y., Ghoda, J., Inoue, J.-I., Mizushima, T., and Sasakawa, C. (2012) The Shigella flexneri effector OspI deamidates UBC13 to dampen the inflammatory response. Nature 483, 623-626.
- Takeshita, K., Tezuka, T., Isozaki, Y., Yamashita, E., Suzuki, M., Kim, M., Yamanashi, Y., Yamamoto, T., and Nakagawa, A. (2012) Structural flexibility regulates phosphopeptide-binding activity of the tyrosine kinase binding domain of Cbl-c. J. Biochem. 52, 487-495.
- Ashida, H., Ogawa, M., Kim, M., Mimuro, H., and Sasakawa, C. (2011) Bacteria and host interactions in the gut epithelial barrier. Nat. Chem. Biol. 8, 36-45.
- Morikawa, H., Kim, M., Mimuro, H., Punginelli, C., Koyama, T., Nagai, S., Miyawaki, A., Iwai, K., and Sasakawa, C. (2010) The bacterial effector Cif interferes with SCF ubiquitin ligase function by inhibiting deneddylation of Cullin1. Biochem. Biophys. Res. Commun. 401, 268-274.
- Ashida, H., Kim, M., Schmidt-Supprian, M., Ma, A., Ogawa, M., and Sasakawa, C. (2010) A bacterial E3 ubiquitin ligase IpaH9.8 targets NEMO/IKKγ to dampen the host NF-κB-mediated inflammatory response. Nat. Cell Biol. 12, 66-73.
- Kim, M., Ashida, H., Ogawa, M., Yoshikawa, Y., Mimuro, H., and Sasakawa, C. (2010) Bacterial interactions with the host epithelium. Cell Host Microbe 8, 20-35.
- Kim, M., Nakamoto, T., Nishimori, S., Tanaka, K., and Chiba, T. (2008) A new ubiquitin ligase involved in p57KIP2 proteolysis regulates osteoblast cell differentiation. EMBO Rep. 9, 878-884.